
Versión 1 - 27/02/22
La pulsioximetría ha mostrado alta probabilidad de ser costo-efectiva para detectar tempranamente cardiopatías congénitas críticas en esta población. Esta información, que proviene del análisis en países de ingresos altos y medio altos* desde la perspectiva del sistema de salud, respalda la recomendación actual de la guía colombiana para la Detección de anomalías congénitas del recién nacido de adicionar esta prueba a la valoración inicial.
*Incluye una evaluación realizada en Colombia
Calidad de la evidencia: moderada (por heterogeneidad en las fuentes para estimar probabilidades en los modelos utilizados y por la naturaleza indirecta de la evidencia para el contexto colombiano).
No se cuenta aún con una herramienta aceptada para calificar la evidencia de evaluaciones económicas
Otros mensaje clave:
- Las cardiopatías congénitas (CC) críticas que se presentan con hipoxemia y que son susceptibles de detección a través de la oximetría de pulso o pulsioximetría son las alteraciones de corazón izquierdo, de los grandes vasos, venas pulmonares y ventrículo único (1).
- Para aplicar los análisis de costo-efectividad es ideal realizar un análisis de transferibilidad, dadas las diferencias socioeconómicas, de práctica clínica y de sistemas de salud con los países donde fueron desarrollados (2).
Es importante saber lo que no se conoce
Aún no se dispone de información completa para alimentar los modelos de los análisis de costo-efectividad (ACE) de pulsioximetrías para detección de CC críticas, por la insuficiente información sobre la evolución clínica y la respuesta de los servicios de salud locales. Por tanto, es necesario hacer uso de supuestos o incluso acudir a la opinión de expertos usando métodos rigurosos y reproducibles como fuentes de información.
Antecedentes
Las CC son anomalías estructurales del corazón o de los grandes vasos que se originan durante el desarrollo embrionario, afectan entre 6.9 a 9.4 niños por 1000 nacidos vivos (3,4) y se estima que en 2 de ellos pueden ser críticas, necesitando intervención quirúrgica urgente para garantizar la supervivencia. Representan una alta carga social y económica, debido a la morbimortalidad asociada por falta de oportunidad en su detección y tratamiento (5). En Colombia en 2020, según el Instituto Nacional de Salud, se presentaron 1680 casos de malformaciones congénitas del sistema circulatorio, de los cuales el 40.1% eran defectos del tabique auriculoventricular, 17.7% conducto arterioso permeable y 6.6 % coartación de la aorta (6).
La detección temprana de las CC puede realizarse mediante ecografía prenatal y examen clínico postnatal. Sin embargo, usando estos métodos más del 30% de los casos críticos no son detectados. Gran parte de las CC críticas presentan hipoxemia, que puede detectarse por oximetría de pulso (pulsioximetría), un método no invasivo ampliamente accesible para evaluar recién nacidos antes del egreso hospitalario. Para este propósito esta prueba tiene una sensibilidad estimada del 76.3% y una especificidad del 99.9% (7).
Varios países han adoptado la pulsioximetría como un método para tamización de CC. En Colombia la Guía de práctica clínica para la detección de anomalías congénitas en el recién nacido recomienda realizar esta prueba en el examen físico después de las 24 horas del nacimiento (8). Sin embargo, para establecer programas de tamización en general se requiere de la evaluación de su eficacia, seguridad, factibilidad y costo-efectividad. Ver punto clave 1
Al respecto, se han publicado varios estudios en Reino Unido, Estados Unidos, Holanda, Colombia y Canadá, en los cuales la pulsioximetría en conjunto con el examen clínico ha mostrado alta probabilidad de ser costo-efectiva a los umbrales de disponibilidad a pagar asumidos (9). La mayoría de estudios se realizaron con árboles de decisión, perspectiva del sistema de salud y horizonte temporal inferior a un año (10, 11, 12, 13, 14), en el estudio Holandés adicionalmente consideraron el contexto de partos domiciliarios (15). El de Colombia estimó que si se desea aumentar en un 1% la probabilidad de un diagnóstico correcto de CC crítica, agregando la pulsioximetría al examen físico del recién nacido, el costo adicional por este resultado sería de USD $100 en un horizonte de una semana. Este resultado sugiere costo-efectividad frente al umbral considerado de USD $26.292. Sin embargo, para un aumento del 1% en la supervivencia al año de vida el costo adicional calculado sería de USD $39.050, por encima del umbral considerado de USD $6.408 (16).
Este Recado presenta el resultado del estudio de modelado más reciente que aborda la pregunta de interés.
Información en la que se basa este Recado
La estrategia de búsqueda se realizó en Pubmed, EMBASE y en bases de estudios económicos (Health Technology Assessment database, base del Centre for reviews and dissemination y Cost-effectiveness analysis registry), sin restricción por idioma. Ver estrategia
En 95 registros obtenidos se encontró una revisión sistemática narrativa y 10 publicaciones de ACE que en su mayoría incluían a la pulsioximetría dentro del examen clínico como estrategia de tamización para las CC críticas, comparándolo con el examen clínico solo. Se seleccionó el estudio de Mukerji (17), realizado en Ontario, Canadá, el cual evalúa la pulsioximetría como prueba única de tamización de CC críticas en las primeras 24 horas del recién nacido a término. Este estudio presenta información actualizada y detallada de los parámetros con los que fue alimentado el modelo.
Resultados
El análisis de costo-efectividad de Mukerji et al. (17), utilizó un modelo de Markov para predecir eventos a lo largo de la vida incluyendo como desenlace los meses de vida ajustados por calidad (QALM, por su sigla en inglés). Esta medida no se había incorporado en los análisis de costo-efectividad de la pulsioximetría en otros países. En su modelo, Mukerji et al. incorporaron ciclos mensuales con seguimiento de por vida, lo que permite considerar variaciones en las tasas de mortalidad, morbilidad y costos, que no serían determinables si se consideraran ciclos anuales. Ver punto clave 2
Aplicaron una tasa de descuento del 1,5% tanto para costos como para los QALM. La calidad de vida en un estado de salud determinado en cada ciclo se representó mediante una puntuación de utilidad correspondiente, considerando que podían variar de 0 (muerte) a 1 (Salud perfecta o sin CC crítica), según la escala. Utilizaron perspectiva del pagador (en este caso del Ministerio de Salud de Ontario) incluyendo costos médicos, de pulsioximetría, ecocardiogramas y hospitalizaciones. El modelo presentó un costo para todas las alternativas expresados en dólares canadienses (CAD). Ver punto clave 3.
Calcularon la relación de costo-efectividad incremental (ICER, por su sigla en inglés) como costo adicional por QALM. El umbral de costo-efectividad utilizado fue de CAD $4.167 por QALM (equivalente a CAD $50.000 por años de vida ajustados por calidad [QALY, por su sigla en inglés] ). Ver punto clave 4.
Asumiendo una incidencia de 4 por 10.000 de CC críticas no detectadas y una sensibilidad de la pulsioximetría del 84.3% para todas las CC, los resultados de este ACE sugieren que con la implementación de esta estrategia:
- Se detectarían anualmente 51 casos adicionales de CC críticas.
- El costo de por vida (en CAD) para el pagador de atención médica por individuo sería de $ 284.002 con la implementación de la pulsioximetría y de $283.975 sin su implementación, con un costo incremental de $27 por individuo*.
- Los QALM esperados por persona con y sin implementación de la pulsioximetría serían 554,53 y 554,50, respectivamente. Habría una ganancia de 0,03 QALM y al considerar 150.000 nacimientos por año habría una ganancia general de 3.682 QALM o 307 QALY por cohorte de nacimiento.
- El costo incremental y los QALM generarían un ICER de $1.110,79, muy por debajo del umbral de costo-efectividad de $ 4.167 considerado*.
*Costos en dólar canadiense (CAD)
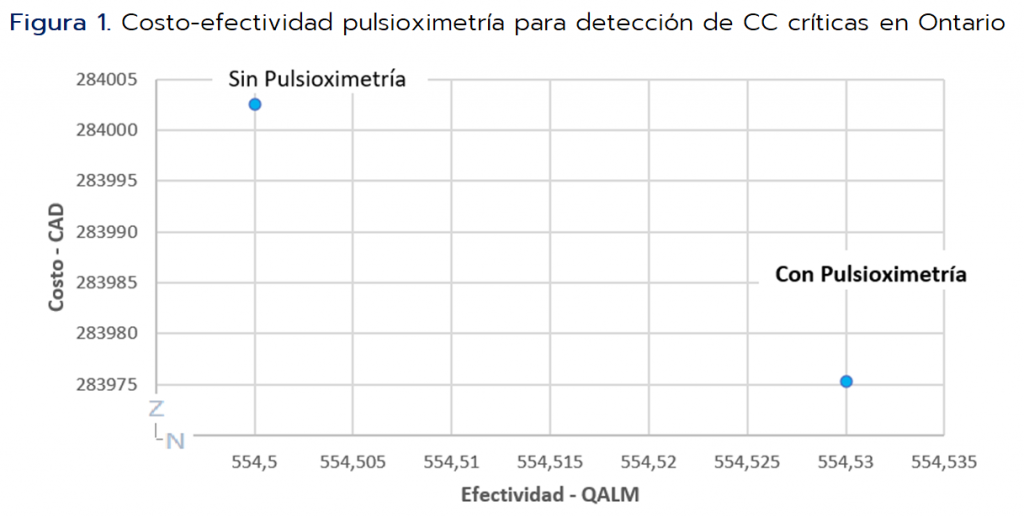
Al evaluar la pulsioximetría vs no realizarla se ubica en el cuadrante I del plano de costo-efectividad, resultando una intervención más efectiva, pero también más costosa. Realizaron análisis de sensibilidad determinístico y probabilístico, encontrando que el modelo fue robusto ante los cambios realizados en los valores de los parámetros individuales y en las simulaciones, con alta probabilidad (>0,9) de que la pulsioximetria resultara costo-efectiva por debajo del umbral predeterminado. Ver punto clave 5
Información sobre la evidencia que soporta este Recado
No existe aún consenso sobre una herramienta para calificar el nivel de certeza de la evidencia en las evaluaciones económicas. Para verificar si el ACE incluido en este Recado cumplía con los estándares de reporte, se empleó la herramienta Consolidated Health Economic Evaluation Reporting Standards (CHEERS) encontrando alto cumplimiento (18). Ver resultado: CHEERS 2022.
Al evaluar críticamente este ACE, se considera que el modelo utilizado es más completo que los estudios previos; resulta coherente, plausible y con las alternativas necesarias para responder la pregunta de investigación. Incluye costos y desenlaces importantes y relevantes, y su valoración es creíble; presenta evidencia de efectividad de la prueba, y la incertidumbre se caracteriza adecuadamente, entre otros aspectos de los considerados en herramientas como la de Drummond et al (19). También se encontró que al sintetizar la evidencia para la estimación de los parámetros, hubo alta heterogeneidad en las fuentes para estimar las probabilidades del modelo.
Referencias
Mahle WT, Newburger JW, Matherne GP, et al. Role of pulse oximetry in examining newborns for congenital heart disease: a scientific statement from the American Heart Association and American Academy of Pediatrics. Pediatrics. 2009;124(2):823–836.
Drummond M, Barbieri M, Cook J, Glick HA, Lis J, Malik F, Reed SD, Rutten F, Sculpher M, Severens J. Transferability of economic evaluations across jurisdictions: ISPOR Good Research Practices Task Force report. Value Health. 2009 Jun;12(4):409-18. doi: 10.1111/j.1524-4733.2008.00489.x. Epub 2009 Jan 12. PMID: 19900249.
Van der Linde D, Konings EE, Slager MA, Witsenburg M, Helbing WA, Takkenberg JJ, Roos-Hesselink JW. Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis. J Am Coll Cardiol. 2011 Nov 15;58(21):2241-7. doi: 10.1016/j.jacc.2011.08.025. PMID: 22078432.
Liu Y, Chen S, Zühlke L, Black GC, Choy MK, Li N, Keavney BD. Global birth prevalence of congenital heart defects 1970-2017: updated systematic review and meta-analysis of 260 studies. Int J Epidemiol. 2019 Apr 1;48(2):455-463. doi: 10.1093/ije/dyz009. PMID: 30783674; PMCID: PMC6469300.
Bakker, M. K., Bergman, J., Krikov, S., Amar, E., Cocchi, G., Cragan, J., de Walle, H., Gatt, M., Groisman, B., Liu, S., Nembhard, W. N., Pierini, A., Rissmann, A., Chidambarathanu, S., Sipek, A., Jr, Szabova, E., Tagliabue, G., Tucker, D., Mastroiacovo, P., & Botto, L. D. (2019). Prenatal diagnosis and prevalence of critical congenital heart defects: an international retrospective cohort study. BMJ open, 9(7), e028139. https://doi.org/10.1136/bmjopen-2018-028139
Instituto Nacional de Salud de Colombia (2021). Informe de evento Defectos Congénitos, Colombia, 2020. Disponible en: https://bit.ly/3vm9ZG6
Plana MN, Zamora J, Suresh G, Fernandez-Pineda L, Thangaratinam S, Ewer AK. Pulse oximetry screening for critical congenital heart defects. Cochrane Database Syst Rev. 2018 Mar 1;3(3):CD011912. doi: 10.1002/14651858.CD011912.pub2. PMID: 29494750; PMCID: PMC6494396.
Ministerio de Salud y Protección Social- Colciencias. Guía de práctica clínica. Detección de anomalías congénitas en el recién nacido. 2013. Disponible en: https://bit.ly/3smplbP
Nargesi S, Rezapour A, Souresrafil A, Dolatshahi Z, Khodaparast F. Cost-Effectiveness Analysis of Pulse Oximetry Screening in the Full-Term Neonates for Diagnosis of Congenital Heart Disease: A Systematic Review. Iran J Pediatr. 2020;30(5):e105393. doi: 10.5812/ijp.105393.
Knowles R, Griebsch I, Dezateux C, Brown J, Bull C, Wren C. Newborn screening for congenital heart defects: a systematic review and cost-effectiveness analysis. Health Technol Assess. 2005 Nov;9(44):1-152, iii-iv. doi: 10.3310/hta9440. PMID: 16297355.
Griebsch I, Knowles RL, Brown J, Bull C, Wren C, Dezateux CA. Comparing the clinical and economic effects of clinical examination, pulse oximetry, and echocardiography in newborn screening for congenital heart defects: a probabilistic cost-effectiveness model and value of information analysis. Int J Technol Assess Health Care. 2007 Spring;23(2):192-204. doi: 10.1017/S0266462307070304. PMID: 17493305.
Ewer AK, Furmston AT, Middleton LJ, Deeks JJ, Daniels JP, Pattison HM, Powell R, Roberts TE, Barton P, Auguste P, Bhoyar A, Thangaratinam S, Tonks AM, Satodia P, Deshpande S, Kumararatne B, Sivakumar S, Mupanemunda R, Khan KS. Pulse oximetry as a screening test for congenital heart defects in newborn infants: a test accuracy study with evaluation of acceptability and cost- effectiveness. Health Technol Assess. 2012;16(2):v-xiii, 1-184. doi: 10.3310/hta16020. PMID: 22284744.
Roberts TE, Barton PM, Auguste PE, Middleton LJ, Furmston AT, Ewer AK. Pulse oximetry as a screening test for congenital heart defects in newborn infants: a cost-effectiveness analysis. Arch Dis Child. 2012 Mar;97(3):221-6. doi: 10.1136/archdischild-2011-300564. Epub 2012 Jan 13. PMID: 22247242.
Peterson C, Grosse SD, Oster ME, Olney RS, Cassell CH. Cost-effectiveness of routine screening for critical congenital heart disease in US newborns. Pediatrics. 2013 Sep;132(3):e595-603. doi: 10.1542/peds.2013-0332. Epub 2013 Aug 5. PMID: 23918890; PMCID: PMC4470475.
Narayen IC, Te Pas AB, Blom NA, van den Akker-van Marle ME. Cost-effectiveness analysis of pulse oximetry screening for critical congenital heart defects following homebirth and early discharge. Eur J Pediatr. 2019 Jan;178(1):97-103. doi: 10.1007/s00431-018-3268-x. Epub 2018 Oct 17. PMID: 30334077; PMCID: PMC6311198.
Londoño Trujillo D, Sandoval Reyes NF, Taborda Restrepo A, Chamorro Velasquez CL, Dominguez Torres MT, Romero Ducuara SV, Troncoso Moreno GA, Aranguren Bello HC, Fonseca Cuevas A, Bermudez Hernandez PA, Sandoval Trujillo P, Dennis RJ. Cost-effectiveness analysis of newborn pulse oximetry screening to detect critical congenital heart disease in Colombia. Cost Eff Resour Alloc. 2019 Jun 24;17:11. doi: 10.1186/s12962-019-0179-2. PMID: 31285695; PMCID: PMC6591944.
Mukerji A, Shafey A, Jain A, Cohen E, Shah PS, Sander B, Shah V. Pulse oximetry screening for critical congenital heart defects in Ontario, Canada: a cost-effectiveness analysis. Can J Public Health. 2020 Oct;111(5):804-811. doi: 10.17269/s41997-019-00280-7. Epub 2020 Jan 6. PMID: 31907759; PMCID: PMC7501328.
Husereau D, Drummond M, Augustovski F, de Bekker-Grob E, Briggs AH, Carswell C, Caulley L, Chaiyakunapruk N, Greenberg D, Loder E, Mauskopf J, Mullins CD, Petrou S, Pwu RF, Staniszewska S. Consolidated Health Economic Evaluation Reporting Standards 2022 (CHEERS 2022) statement: updated reporting guidance for health economic evaluations. MDM Policy Pract. 2022 Jan 11;7(1):23814683211061097. doi: 10.1177/23814683211061097.
Drummond MF, S. M., Claxton K, Stoddart GL, Torrance GW (2015). Methods for the Economic Evaluation of Health Care Programmes. Oxford - United Kingdom.
