Versión 1 - 11/06/20
Los síntomas gastrointestinales (GI)* al momento del diagnóstico de la COVID-19 se relacionan con un peor curso clínico de la enfermedad, en términos de mayor riesgo de síndrome de dificultad respiratoria agudo (SDRA) y de disfunción hepática (DH).
*Incluyen pérdida de apetito, diarrea, náusea, vómito y dolor abdominal. Excluye comorbilidades previas del sistema digestivo
Calidad de la evidencia: baja a moderada dependiendo del desenlace (sesgos de selección, inconsistencia en los resultados).
Otros mensajes clave
- Alrededor de 10% de los pacientes con COVID-19 presentan síntomas GI sin desarrollar síntomas respiratorios, lo que puede retrasar el diagnóstico de la enfermedad.
- La incidencia estimada de DH es 18% en pacientes adultos con COVID-19 y 10% en los pacientes pediátricos.
- Los pacientes con formas graves de la COVID-19 tienen mayor riesgo de desarrollar DH, por lo que se sugiere monitorear los niveles de bilirrubina y aminotransferasas.
Es importante saber lo que no se conoce
Se desconoce la asociación entre la presencia de síntomas GI o DH sobre la mortalidad en esta población. Tampoco se dispone de información suficiente para establecer el impacto de los síntomas GI o la DH en presencia de otros factores que afectan el pronóstico de pacientes con la COVID-19 (V.g. edad, comorbilidades crónicas).
Antecedentes
Las manifestaciones clínicas de la COVID-19 incluyen síntomas respiratorios y fiebre (1). La presencia de diarrea, dolor abdominal, náuseas y vómito al momento del diagnóstico se ha reportado cada vez con mayor frecuencia, e incluso puede preceder a la aparición de síntomas respiratorios (1,2). La enzima convertidora de angiotensina II (ECA-II) (3) y las proteasas de transmembrana de serina 2 y 4 (TMPRSS2 y TMPRSS4) promueven la entrada del virus a la célula (4); la expresión de estas proteínas en el sistema digestivo -principalmente en el intestino delgado, grueso, esófago e hígado- podría explicar el compromiso a este nivel en la infección por SARS-CoV-2 (5). Se considera entonces que, la presencia de síntomas GI puede tener un impacto negativo sobre el curso clínico y pronóstico de la COVID-19 (6).
Este Recado reseña una revisión sistemática de estudios observacionales, que permite conocer la prevalencia de síntomas GI o DH en pacientes con la COVID-19 y su asociación con el curso clínico de la enfermedad.
Información en la que se basa este recado
Usando la base Epistemonikos se identificaron 421 revisiones sistemáticas (RS); 23 de ellas relacionadas con síntomas GI o DH. Se seleccionó la RS de Mao (7) por incluir un mayor número de estudios publicados y obtener el mejor puntaje en la evaluación de calidad con el instrumento A measurement Tool to Assess Systematic Reviews (AMSTAR) (8).
Resultados
La RS de Mao evaluó la evidencia publicada entre enero 1 y abril 4 de 2020, con el objetivo de definir la prevalencia de síntomas GI o DH en los pacientes con diagnóstico de la COVID-19 y su impacto sobre el curso clínico, gravedad de la enfermedad y muerte. La RS incluyó 35 estudios en 6686 pacientes con diagnóstico de COVID-19. De estos, 29 estudios (n=6064) reportaron la frecuencia de síntomas GI al momento de diagnóstico y 12 (n=1267) la de DH. La mayoría de estudios incluyeron adultos; seis incluyeron niños y adultos y cuatro únicamente población pediátrica. La calidad metodológica de los estudios incluidos fue evaluada por los autores usando la herramienta Quality Assessment Tool for Case Series Studies (9).
Se estimó la prevalencia de síntomas GI de novo así como la de comorbilidades del sistema digestivo al momento del diagnóstico. La DH fue definida por la elevación de la alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y bilirrubina total (BT). La COVID-19 grave, se definió como saturación de oxígeno (SaO2) <90%, necesidad de admisión a UCI o presencia de SDRA. Adicionalmente, los autores evaluaron diferencias en la presentación de estos síntomas entre la población adulta y pediátrica.
Los metaanálisis reportan estimaciones agrupadas de la asociación entre la presencia de síntomas GI al momento del diagnóstico y la gravedad de la COVID-19 o la mortalidad usando los OR (del inglés Odds ratio) informados por los estudios individuales. También se reportan OR para la presentación de síntomas GI o DH entre los pacientes con COVID-19 grave vs COVID-19 no grave.
Principales hallazgos
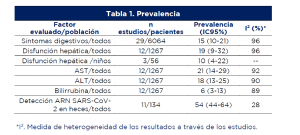
- La prevalencia agrupada de síntomas GI, DH y presencia de ARN de SARS-CoV-2 en heces se muestra en la tabla 1:
- Las prevalencias reportadas en los estudios varían significativamente entre sí (I2>90% en la mayoría de casos).
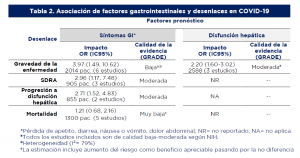
- La asociación entre síntomas GI o DH y los desenlaces clínicos de interés informados por los estudios se muestra en la tabla 2:
- Debido a la imprecisión de las estimaciones, no fue posible definir el efecto que tiene la presencia de síntomas GI sobre la mortalidad, ni el de las comorbilidades digestivas previas al diagnóstico de la COVID-19 sobre la gravedad de la enfermedad.
- Los autores reportan que la prevalencia de síntomas GI fue similar en la población adulta y pediátrica, sin presentar los datos correspondientes.
Información sobre la evidencia que soporta este Recado
De acuerdo con el instrumento AMSTAR, la confianza general en los resultados de la RS de Mao (7) es alta. Sin embargo los estudios incluidos resultaron ser de baja o moderada calidad según la valoración de los autores. La calidad de la evidencia para cada uno de los desenlaces usando el método GRADE se muestra en la Tabla 2. El nivel de la evidencia sobre síntomas GI se ve afectado por la heterogeneidad en los resultados de los diferentes estudios y por posibles sesgos de publicación (Egger test p<0•0001) (nivel de evidencia bajo). En contraste, la evidencia para DH mostró resultados más consistentes entre los estudios y los autores de la RS no identificaron sesgo de publicación (nivel de evidencia moderado).
Referencias
Guan W-J, Ni Z-Y, Hu Y, Liang W-H, Ou C-Q, He J-X, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med [Internet]. 2020;1–13. Disponible en: https://bit.ly/2Top7PC
Xiao F, Meiwen T, Xiaobin Z, Ye L, Xiaofeng L, Hong S. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology [Internet]. 2020;21(1):1–9. Disponible en: https://bit.ly/2Ayx66k
Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med. 2020;
Zang R, Castro MFG, McCune BT, Zeng Q, Rothlauf PW, Sonnek NM, et al. TMPRSS2 and TMPRSS4 mediate SARS-CoV-2 infection of human small intestinal enterocytes. bioRxiv. 2020;3582(May):2020.04.21.054015.
Qi J, Zhou Y, Hua J, Zhang L, Bian J, Liu B, et al. The scRNA-seq expression profiling of the receptor ACE2 and the cellular protease TMPRSS2 reveals human organs susceptible to COVID-19 infection. bioRxiv [Internet]. 2020;2020.04.16.045690. Disponible en: https://bit.ly/2YG4gt4.
Cheung K, Hung I, Chan P, Lung K, Tso E, Liu R, et al. Gastrointestinal Manifestations of SARS-CoV-2 Infection and Virus Load in Fecal Samples from the Hong Kong Cohort and Systematic Review and Meta-analysis. Gastroenterology. 2020;1–46.
Mao R, Qiu Y, He JS, Tan JY, Li XH, Liang J, et al. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol [Internet]. 2020;1253(20). Disponible en: https://bit.ly/37sRuSu
Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: A critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017;358:1–9.
National Heart, Lung and BI. Study quality assessment tools. [Internet]. [cited 2020 May 19]. Disponible en: https://bit.ly/3hlLgZ8