
Versión 1 - 10/03/21
El uso de tocilizumab como parte del tratamiento de pacientes hospitalizados por COVID-19 severo, se asocia con una reducción en el requerimiento de ventilación mecánica invasiva y la mortalidad a 28 días. El beneficio se observó en pacientes que estaban siendo tratados simultáneamente con corticoesteroides*. Por tanto, de estar disponible, el tocilizumab debería ser parte del tratamiento de estos pacientes.
*Dexametasona.
Calidad de la evidencia: alta (bajo riesgo de sesgo, resultados precisos en un desenlace altamente relevante).
Buena práctica para pacientes
• El tocilizumab no es un producto que pueda adquirirse en una farmacia. Su uso debe limitarse al escenario hospitalario ya que la administración es únicamente intravenosa.
• Este Recado NO presenta información sobre el uso de tocilizumab como tratamiento en pacientes con formas leves o asintomáticas.
Mensajes clave
- El tocilizumab es un tratamiento efectivo para pacientes hospitalizados por la COVID-19 que presentan hipoxia y evidencia de inflamación (proteína C reactiva ≥75 mg/L).
- Los beneficios del tratamiento se observan en un amplio espectro de pacientes y son consistentes en los subgrupos más representativos (días desde el inicio de los síntomas, soporte ventilatorio y uso de corticoides).
- Después de la asignación aleatoria, el 17% de los pacientes en el grupo de tocilizumab no recibieron el tratamiento, sin registrar las causas. Por tanto, el tamaño del efecto reportado podría ser una subestimación del efecto verdadero del tratamiento.
Es importante saber lo que no se conoce
No se conoce el beneficio del tratamiento en otro perfil de pacientes (con hipoxemia y proteína C reactiva <75 mg/L). Dado que la estancia hospitalaria para muchos de estos pacientes es prolongada (mediana >28 días), el análisis previsto para los 6 meses debería proporcionar información adicional sobre los efectos clínicos del tocilizumab a mediano plazo.
Antecedentes
Debido al antagonismo de la interleucina (IL) 6 y, por ende, la respuesta inflamatoria del huésped, el tocilizumab* sería una opción terapéutica para la COVID-19 (1). La mayoría de las infecciones por SARS-CoV-2 cursan de manera asintomática o como una enfermedad leve. Sin embargo, algunos casos desarrollan enfermedad severa con un proceso inflamatorio a nivel pulmonar (2) con liberación de citoquinas proinflamatorias y eventualmente una repuesta inflamatoria sistémica (3). Por tanto, la administración de agentes inmunomoduladores específicos como tocilizumab podría tener un efecto benéfico sobre desenlaces clínicos en pacientes con la COVID-19 (3,4).
El análisis preliminar de estudios observacionales iniciales no permitía sacar conclusiones respecto a beneficio o daño con esta intervención, con un alto riesgo de sesgo y limitaciones en la calidad metodológica de la evidencia disponible (calidad muy baja) (5–7). Los ensayos clínicos posteriores en la COVID-19 mostraron resultados contradictorios. Por un lado, el uso de tocilizumab no resultó en una mejoría clínica o reducción en la mortalidad a 28 días (8,9). Por otro, en pacientes críticamente enfermos con requerimiento de soporte en UCI, el tratamiento con tocilizumab y sarilumab mostró mejoría en desenlaces clínicos, incluyendo sobrevida (10), y en pacientes con neumonía por la COVID-19 redujo la posibilidad de progresión al desenlace compuesto ventilación mecánica o muerte, sin mejorar la sobrevida (11).
Este Recado reseña los resultados del experimento Recovery (Randomised Evaluation of COVID-19 Therapy) que proveen evidencia robusta del efecto del tocilizumab sobre desenlaces clínicos en pacientes con la COVID-19 que requieren hospitalización (12).
*El tocilizumab es un anticuerpo monoclonal humanizado recombinante que inhibe la unión de la IL-6 a sus receptores, bloqueando su señalización y reduciendo la inflamación. Comúnmente se ha empleado en condiciones como la artritis reumatoidea (4). Es un medicamento biológico de alto costo, con registro sanitario para esta indicación, aunque no se encuentra ampliamente disponible en Colombia (13).
Información en la que se basa este Recado
Por monitoreo de repositorios de información se seleccionó el reporte en preimpresión de los resultados del estudio Recovery.
Resultados
Recovery (12) es un proyecto de investigación en tratamientos para la COVID-19 que conduce varios experimentos clínicos aleatorizados, de etiqueta abierta y adaptativos. Incluye pacientes hospitalizados (131 sitios en el Servicio Nacional de Salud en el Reino Unido) con sospecha clínica o infección por SARS-CoV-2 confirmada. Ha reclutado más de 38 mil participantes desde el 19 de marzo de 2020.
Todos los pacientes elegibles han sido distribuidos en tres experimentos (figura 1).
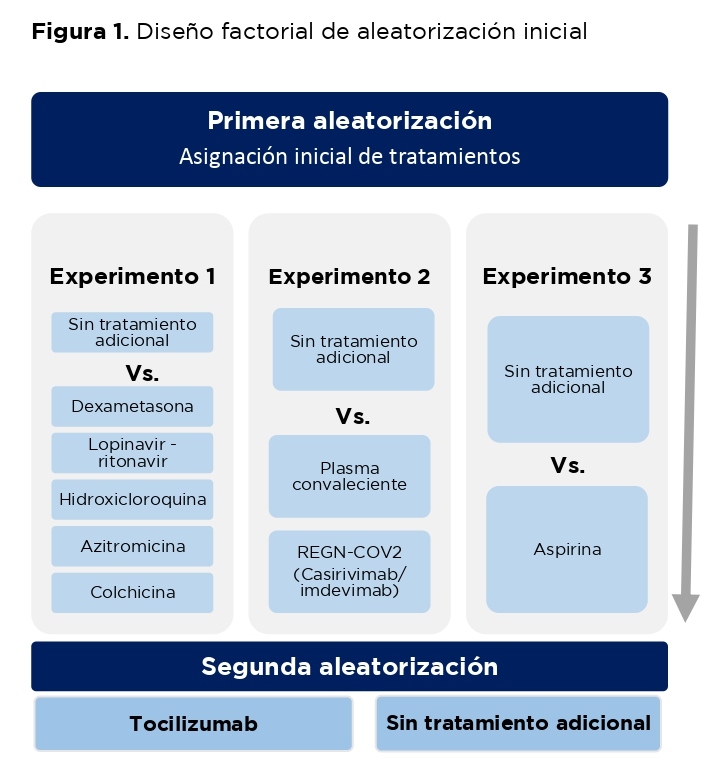
Hasta 21 días después de ingresar al proyecto, un subgrupo de 4 116 pacientes con evidencia clínica de la COVID-19 progresivo (saturación de oxígeno <92% al ambiente o recibiendo oxigenoterapia y proteína C reactiva ≥75 mg/L) fueron aleatorizados a recibir tocilizumab adicional al tratamiento estándar (n=2 022) o solo tratamiento estándar (n=2 094).
La edad promedio de los participantes fue de 63.6 (DE 13.7) años y al igual que las otras características demográficas registradas fueron comparables entre los grupos. Al momento de la aleatorización 562 (14%) pacientes recibían ventilación mecánica invasiva, 1 686 (41%) soporte ventilatorio no invasivo y 1 868 (45%) oxigeno suplementario. La mediana de proteína C reactiva fue 143 mg/L (RIQ 107-204) y 3 375 (82%) de los pacientes habían recibido corticoesteroides al momento de la aleatorización.
Los pacientes asignados al grupo de tocilizumab recibieron inicialmente el medicamento por infusión intravenosa durante 60 minutos con una dosis determinada por peso corporal*. Si a juicio del médico tratante, la condición del paciente no había mejorado, se podía administrar una segunda dosis 12 a 24 horas más tarde. Para el registro de desenlaces, se completó un único formulario cuando los participantes fueron: (A) dados de alta, (B) murieron o (C) después de 28 días de la asignación a este tratamiento, lo que ocurriera primero.
Se condujo un análisis por intención de tratar. El desenlace principal fue mortalidad por cualquier causa y se realizó un análisis por subgrupos definidos por seis características de base: edad, sexo, etnia, nivel de soporte ventilatorio, días desde el inicio de los síntomas y uso de corticoides sistémicos. Los desenlaces secundarios incluyeron tiempo de sobrevida al egreso hospitalario e inicio de ventilación mecánica (incluida la oxigenación de membrana extracorpórea) o muerte. Otros desenlaces secundarios fueron el uso de ventilación no invasiva, tiempo para la extubación exitosa y el uso de hemodiálisis o hemofiltración. Adicionalmente, se evaluaron resultados de seguridad como mortalidad por causas específicas, arritmia cardiaca mayor y eventos adversos serios. El comité de evaluación de datos suspendió el reclutamiento el 24 de enero de 2021 al tener más de 4 000 pacientes aleatorizados, superando el tamaño de la muestra esperada para esta comparación.
*800 mg si el peso >90 kg; 600 mg si el peso >65 kg y ≤90 kg; 400 mg si el peso >40 kg y ≤65 kg; y 8 mg/kg si el peso ≤40 kg.
Los principales hallazgos con el uso de tocilizumab son:
- Los pacientes asignados a tocilizumab presentaron una menor mortalidad a 28 días comparados con los de tratamiento estándar (29% vs 33%; RR 0.86, IC95% 0.77-0.96). Este efecto fue independiente del momento de inicio de la terapia y similar en todos los subgrupos preespecificados, incluido el nivel de soporte ventilatorio en el momento de la aleatorización.
- En un análisis exploratorio incluyendo solo pacientes con prueba positiva para SARS-CoV-2 (n=3 858), el resultado sobre mortalidad fue similar (RR 0.87, IC95% 0.78-0.98).
- Los pacientes asignados a tocilizumab tuvieron tasa de supervivencia a 28 días en comparación con el tratamiento estándar (54% vs 47%; RR 1.22, IC95% 1.12-1.34).
- El uso de tocilizumab se asoció con una reducción del riesgo del desenlace compuesto de inicio de ventilación mecánica invasiva o muerte (33% vs 38%; RR 0.85, IC95% 0.78-0.93).
- La asignación al grupo de tocilizumab redujo el uso de hemodiálisis o hemofiltración (5%, vs 7%; RR 0.75, IC95% 0.59-0.96).
- El uso de tocilizumab no tuvo ningún efecto significativo en:
- Requerimiento de soporte ventilatorio (no invasivo o ventilación mecánica invasiva), entre los pacientes que no tenían soporte ventilatorio en el momento de la aleatorización.
- En contraste, en los pacientes con ventilación mecánica invasiva en el momento de la aleatorización, no tuvo efecto en la tasa de extubación exitosa.
- No se identificó un exceso de muertes por otras infecciones ni diferencias en la frecuencia de arritmias cardiacas mayores.
- Solo se reportaron tres eventos adversos serios en pacientes asignados a tocilizumab: una otitis externa, una bacteremia por Staphylococcus aureus y un absceso pulmonar. Todos se resolvieron con el tratamiento estándar.
- El uso de dexametasona se asoció con una reducción en mortalidad por todas las causas a 28 días.
Información sobre la evidencia que soporta este Recado
El estudio Recovery fue calificado como bajo riesgo de sesgo según el instrumento Risk of bias (RoB2) (14) para evaluar ECA. Con base en los resultados preliminares, la certeza en la evidencia para el desenlace de mortalidad en los pacientes hospitalizados por COVID-19 se consideró alta (bajo riesgo de sesgo, resultados precisos en un desenlace altamente relevante) al igual que para la tasa de egreso hospitalario al día 28 y el desenlace compuesto de requerimiento de ventilación mecánica o muerte.
Referencias
Pan American Health O. Ongoing Living Update of Potential COVID-19 Therapeutics: summary of rapid systematic reviews. 2020;17. Available from: http://fi-admin.bvsalud.org/document/view/5n52c
Guan W-J, Ni Z-Y, Hu Y, Liang W-H, Ou C-Q, He J-X, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med [Internet]. 2020;1–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32109013
Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of COVID-19: Current State of the Science. Immunity. 2020;52(6):910–41.
Roumier M, Paule R, Groh M, Vallée A, Ackermann F. Interleukin-6 blockade for severe COVID-19. medRxiv [Internet]. 2020 Jan 1;2020.04.20.20061861. Available from: http://medrxiv.org/content/early/2020/04/22/2020.04.20.20061861.abstract
Khan F, Fabbri L, Stewart I, Smyth A, Robinson K, Jenkins G. A systematic review of Anakinra, Tocilizumab, Sarilumab and Siltuximab for coronavirus-related infections. medRxiv [Internet]. 2020 Jan 1;2020.04.23.20076612. Available from: http://medrxiv.org/content/early/2020/04/26/2020.04.23.20076612.abstract
Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020 May;117(20):10970–5.
Cellina M, Orsi M, Bombaci F, Sala M, Marino P, Oliva G. Favorable changes of CT findings in a patient with COVID-19 pneumonia after treatment with tocilizumab. Vol. 101, Diagnostic and interventional imaging. 2020. p. 323–4.
Rosas IO, Bräu N, Waters M, Go RC, Hunter BD, Bhagani S, et al. Tocilizumab in Hospitalized Patients with Severe Covid-19 Pneumonia. N Engl J Med [Internet]. 2021 Feb 25; Available from: https://doi.org/10.1056/NEJMoa2028700
Veiga VC, Prats JAGG, Farias DLC, Rosa RG, Dourado LK, Zampieri FG, et al. Effect of tocilizumab on clinical outcomes at 15 days in patients with severe or critical coronavirus disease 2019: randomised controlled trial. BMJ [Internet]. 2021 Jan 20;372:n84–n84. Available from: https://pubmed.ncbi.nlm.nih.gov/33472855
The REMAP-CAP Investigators. Interleukin-6 Receptor Antagonists in Critically Ill Patients with Covid-19. N Engl J Med [Internet]. 2021 Feb 25; Available from: https://doi.org/10.1056/NEJMoa2100433
Salama C, Han J, Yau L, Reiss WG, Kramer B, Neidhart JD, et al. Tocilizumab in Patients Hospitalized with Covid-19 Pneumonia. N Engl J Med. 2021 Jan;384(1):20–30.
RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with 3 COVID-19 (RECOVERY): preliminary results of a 4 randomised, controlled, open-label, platform trial. medRxiv. 2021;
Minsalud. Tecnologías en salud para combatir la COVID-19, siguen siendo estudiadas a través de importantes esfuerzos colectivos a nivel internacional. 2020.
Sterne J, Savović J, Page M, Elbers R, Blencowe N, Boutron I, et al. RoB 2: a revised tool for assessing risk of bias in randomised trials. BMJ. 2009;(366):l4898.
