
Versión 1 - 17/05/22
En pacientes con infección leve a moderada por SARS-CoV-2 no hospitalizados que no hayan recibido vacunas y tengan factores de riesgo para complicaciones, se recomienda la administración de antiviralesⱡ (remdesivir*+, molnupiravir** o nirmatrelvir/ritonavir+) en los primeros 5 días del inicio de los síntomas, para reducir el riesgo de hospitalización o muerte.
ⱡ Considerar de acuerdo a disponibilidad en el país | *Uso intravenoso (IV)| + Uso vía oral (VO) | ** Aprobado por INVIMA para uso en Colombia
Certeza de la evidencia: Alta para los estudios que evaluaron remdesivir, molnupiravir y nirmatrelvir/ritonavir; moderada para favipiravir y remdesivir por posible sesgo de selección por suspensión temprana del estudio
Otros mensajes clave:
- El estudio con favipiravir no mostró beneficio en cuanto a su desenlace principal de aclaramiento viral.
- Nirmatrelvir/ritonavir redujo la carga viral al día 5 de tratamiento.
- La incidencia de efectos adversos (predominantemente gastrointestinales y elevación de enzimas hepáticas), no graves, fue variable entre los estudios.
Es importante saber lo que no se conoce
Se desconoce si la eficacia de los antivirales varía frente a las nuevas variantes del virus o el estado de vacunación.
Antecedentes
Más de 400 millones de casos y cerca de 6 millones de muertes por SARS-CoV-2 han ocurrido desde el inicio de la pandemia por COVID-19 (1,2). A pesar de la aparición de múltiples estudios sobre el tratamiento antiviral (3), solo algunos fármacos probaron ser eficaces y seguros (4,5). Esta situación contrasta con el rápido desarrollo e implementación de diferentes tipos de vacunas que han logrado reducir la morbimortalidad (6,7).
Entre los estudios que evalúan agentes antivirales, algunas revisiones sistemáticas han concluido no beneficio con el tratamiento para COVID-19 moderado a severo en pacientes hospitalizados que recibieron favipiravir (8) o hidroxicloroquina (9). Asimismo, la evidencia ha sido insuficiente para recomendar el uso de ivermectina (10) y colchicina (11). En tanto, se tienen datos que muestran beneficio con el uso de remdesivir en pacientes hospitalizados con requerimiento de oxígeno suplementario (12). Así, el único antiviral recomendado en las principales guías de práctica clínica es remdesidivir (13-16).
Dada la mayor replicación viral al inicio de la enfermedad, y su impacto potencial en la severidad, los antivirales podrían tener mayor utilidad en los primeros días de síntomas. El propósito de este Recado es informar el impacto clínico de los antivirales estudiados en fases tempranas y no complicadas de la infección por Sars-CoV-2.
Información en la que se basa este Recado
La búsqueda de literatura se realizó en la plataforma L.OVE (Living Overview of Evidence), en las bases de datos MEDLINE, EMBASE, Cochrane Central, clinicaltrials.gov y fuentes de manuscritos no arbitrados como medRxiv (2019-2022). La pregunta en formato PICO para la búsqueda se construyó a partir de los términos “COVID-19”, “favipiravir” (avifavir), “remdesivir”, “molnupiravir”, “nirmatrelvir/ritonavir” (Paxlovid) y “clinical trials”. Se seleccionaron los estudios de Bosaeed et al (favipiravir), Gottlieb et al (remdesivir), Jayk Bernal et al (molnupiravir) y Hammond et al (nirmatrelvir/ritonavir), todos multicéntricos (17-20).
Los experimentos con molnupiravir, favipiravir y nirmatrelvir/ritonavir incluyeron pacientes desde los 18 años. Con remdesivir, se reclutaron participantes desde los 12 años. Haber recibido vacunación contra COVID-19 fue criterio de exclusión explícito con remdesivir, molnupiravir y nirmatrelvir/ritonavir, pero no se menciona en el ensayo con favipiravir. En este último estudio tampoco fue criterio de inclusión la presencia de factores de riesgo para severidad (ej. edad mayor de 60 años u otra condición).
Los esquemas de tratamiento iniciados dentro de los 5-7 días previos a la aleatorización fueron:
- Favipiravir: 1800 mg VO cada 12 horas el día 1, seguido de 800 mg VO cada 12 horas durante 5 a 7 días.
- Remdesivir: 200 mg IV el día 1, seguido de 100 mg IV/día los días 2 y 3.
- Molnupiravir: 800 mg VO cada 12 horas durante 5 días.
- Nirmatrelvir/ritonavir: 300 mg/100 mg VO cada 12 horas durante 5 días.
Los estudios con remdesivir, molnupiravir y nirmatrelvir/ritonavir incluyeron como desenlaces de eficacia y seguridad la incidencia de hospitalización o muerte por cualquier causa al día 28-29 e incidencia de eventos adversos respectivamente. En los estudios con favipiravir y nirmatrelvir/ritonavir se usó como desenlace el aclaramiento viral en los primeros 15 días posinicio del tratamiento.
Resultados
En general, los participantes en los estudios fueron adultos de edad media, con una representación similar por sexo. Las comorbilidades más prevalentes fueron obesidad y diabetes. Las características de la población incluida se presentan en la tabla 1.
En el estudio con favipiravir, el comité de seguridad y monitoreo datos recomendó suspender por futilidad el reclutamiento luego del primer análisis interino (40% de los participantes). Con remdesivir se detuvo el reclutamiento cuando el estudio acumulaba el 44.5% de los pacientes. Ambos casos basan su decisión en la baja incidencia de infecciones y preocupaciones éticas como la disponibilidad de nuevas terapias e incremento de la vacunación (tabla 2).
Al realizar metaanálisis de los resultados de los estudios con remdesivir, molnupiravir y nermatrelvir/ritonavir para el desenlace combinado de requerimiento de hospitalización o muerte por cualquier causa al día 28 se encuentra que en los 3 estudios el beneficio está a favor del uso de antivirales, con significancia estadística y una heterogeneidad relativamente baja (Figura 1).
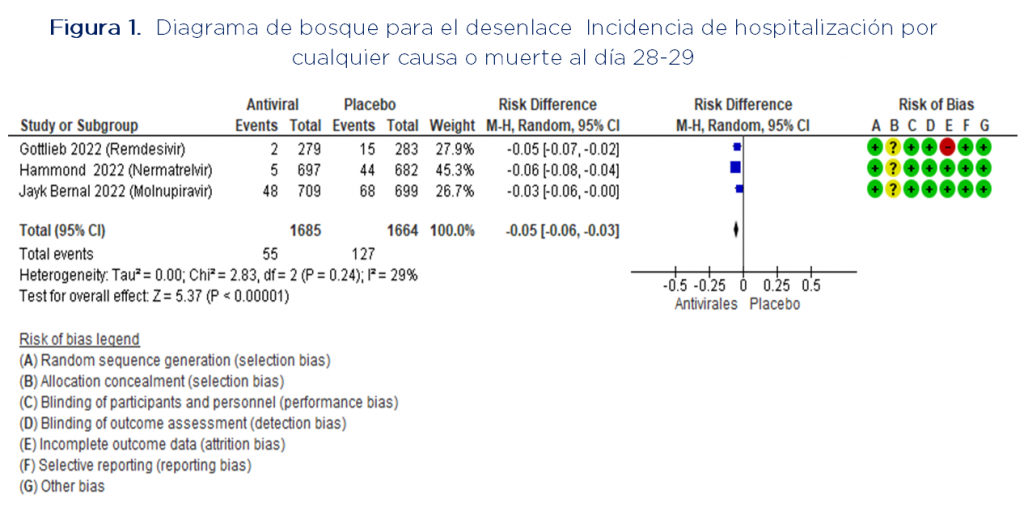
Información sobre la evidencia que soporta este Recado
La evaluación crítica de los cuatro estudios con la herramienta RoB2 permite concluir bajo riesgo de sesgos para los estudios con molnuipiravir y nirmatrelvir/ritonavir. Existen algunas preocupaciones con favipiravir y remdesivir dada la suspensión del estudio antes de tiempo (Anexo 1)
Referencias
World Health Organization. WHO Coronavirus (COVID-19) Dashboard. Disponible en: https://covid19.who.int/. Consultado [13 Feb 2022].
Organización Mundial de la Salud [Internet]. Alocución de apertura del director general en la rueda de prensa sobre la COVID-19 celebrada el 11 de marzo de 2020. Disponible en: https://bit.ly/2F7pJFn. [Consultado el 13 feb 2022]
The COVID-NMA initiative. A living mapping and living systematic review of Covid-19 trials. An international research initiative supported by the WHO and Cochrane.Disponible en: https://covid-nma.com/. Consultado [14 Feb 2022].
Vegivinti CTR, Evanson KW, Lyons H, Akosman I, Barrett A, Hardy N, Kane B, Keesari PR, Pulakurthi YS, Sheffels E, Balasubramanian P, Chibbar R, Chittajallu S, Cowie K, Karon J, Siegel L, Tarchand R, Zinn C, Gupta N, Kallmes KM, Saravu K, Touchette J. Efficacy of antiviral therapies for COVID-19: a systematic review of randomized controlled trials. BMC Infect Dis. 2022 Jan 31;22(1):107. doi: 10.1186/s12879-022-07068-0
Okoli GN, Rabbani R, Al-Juboori A, Copstein L, Askin N, Abou-Setta AM. Antiviral drugs for coronavirus disease 2019 (COVID-19): a systematic review with network meta-analysis. Expert Rev Anti Infect Ther. 2022 Feb;20(2):267-278. doi: 10.1080/14787210.2021.1961579
Ling Y, Zhong J, Luo J. Safety and effectiveness of SARS-CoV-2 vaccines: A systematic review and meta-analysis. J Med Virol. 2021 Dec;93(12):6486-6495. doi: 10.1002/jmv.27203
Zheng C, Shao W, Chen X, Zhang B, Wang G, Zhang W. Real-world effectiveness of COVID-19 vaccines: a literature review and meta-analysis. Int J Infect Dis. 2022 Jan;114:252-260. doi: 10.1016/j.ijid.2021.11.009.
Özlüşen B, Kozan Ş, Akcan RE, Kalender M, Yaprak D, Peltek İB, Keske Ş, Gönen M, Ergönül Ö. Effectiveness of favipiravir in COVID-19: a live systematic review. Eur J Clin Microbiol Infect Dis. 2021 Dec;40(12):2575-2583. doi: 10.1007/s10096-021-04307-1.
Singh B, Ryan H, Kredo T, Chaplin M, Fletcher T. Chloroquine or hydroxychloroquine for prevention and treatment of COVID‐19. Cochrane Database of Systematic Reviews 2021, Issue 2. Art. No.: CD013587. DOI: 10.1002/14651858.CD013587.pub2
Popp M, Stegemann M, Metzendorf MI, Gould S, Kranke P, Meybohm P, Skoetz N, Weibel S. Ivermectin for preventing and treating COVID-19. Cochrane Database Syst Rev. 2021 Jul 28;7(7):CD015017. doi: 10.1002/14651858.CD015017.pub2
Mikolajewska A, Fischer AL, Piechotta V, Mueller A, Metzendorf MI, Becker M, Dorando E, Pacheco RL, Martimbianco ALC, Riera R, Skoetz N, Stegemann M. Colchicine for the treatment of COVID-19. Cochrane Database Syst Rev. 2021 Oct 18;10(10):CD015045. doi: 10.1002/14651858.CD015045.
Thiruchelvam K, Kow CS, Hadi MA, Hasan SS. The use of remdesivir for the management of patients with moderate-to-severe COVID-19: a systematic review. Expert Rev Anti Infect Ther. 2022 Feb;20(2):211-229. doi: 10.1080/14787210.2021.1949984
Therapeutics and COVID-19: living guideline. World Health Organization. Disponible en: https://www.who.int/publications/i/item/WHO-2019-nCoV-therapeutics-2022.1. Consultado [14 Feb 2022].
COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Disponible en: https://www.covid19treatmentguidelines.nih.gov/. Consultado [13 Feb 2022].
IDSA Guidelines on the Treatment and Management of Patients with COVID-19. Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Disponible en: https://www.idsociety.org/COVID19guidelines . Consultado [13 Feb 2022].
COVID-19 rapid guideline: managing COVID-19. National Institute of Health of Care Excellence. NICE guideline [NG191]. Disponible en: https://www.nice.org.uk/guidance/ng191 . Consultado [13 Feb 2022].
Bosaeed M, Alharbi A, Mahmoud E, Alrehily S, Bahlaq M, Gaifer Z, Alturkistani H, Alhagan K, Alshahrani S, Tolbah A, Musattat A, Alanazi M, Jaha R, Sultana K, Alqahtani H, Al Aamer K, Jaser S, Alsaedy A, Ahmad A, Abalkhail M, AlJohani S, Al Jeraisy M, Almaziad S, Albaalharith N, Alabdulkareem K, Alshowair A, Alharbi NK, Alrabiah F, Alshamrani M, Aldibasi O, Alaskar A. Efficacy of favipiravir in adults with mild COVID-19: a randomized, double-blind, multicentre, placebo-controlled clinical trial. Clin Microbiol Infect. 2022 Jan 11:S1198-743X(21)00734-5. doi: 10.1016/j.cmi.2021.12.026
Gottlieb RL, Vaca CE, Paredes R, Mera J, Webb BJ, Perez G, Oguchi G, Ryan P, Nielsen BU, Brown M, Hidalgo A, Sachdeva Y, Mittal S, Osiyemi O, Skarbinski J, Juneja K, Hyland RH, Osinusi A, Chen S, Camus G, Abdelghany M, Davies S, Behenna-Renton N, Duff F, Marty FM, Katz MJ, Ginde AA, Brown SM, Schiffer JT, Hill JA; GS-US-540-9012 (PINETREE) Investigators. Early Remdesivir to Prevent Progression to Severe Covid-19 in Outpatients. N Engl J Med. 2022 Jan 27;386(4):305-315. doi: 10.1056/NEJMoa2116846
Jayk Bernal A, Gomes da Silva MM, Musungaie DB, Kovalchuk E, Gonzalez A, Delos Reyes V, Martín-Quirós A, Caraco Y, Williams-Diaz A, Brown ML, Du J, Pedley A, Assaid C, Strizki J, Grobler JA, Shamsuddin HH, Tipping R, Wan H, Paschke A, Butterton JR, Johnson MG, De Anda C; MOVe-OUT Study Group. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med. 2022 Feb 10;386(6):509-520. doi: 10.1056/NEJMoa2116044.
Hammond J, Leister-Tebbe H, Gardner A, Abreu P, Bao W, Wisemandle W, Baniecki M, Hendrick VM, Damle B, Simón-Campos A, Pypstra R, Rusnak JM; EPIC-HR Investigators. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19. N Engl J Med. 2022 Feb 16:NEJMoa2118542. doi: 10.1056/NEJMoa2118542.
