Versión 1 - 20/03/2024
Evidencia experimental muestra que en pacientes con fibrilación auricular subclínica o episodios auriculares de alta frecuencia* detectados incidentalmente por el uso de dispositivos cardíacos (marcapasos, cardiodesfibrilador implantable, etc.) el uso de anticoagulantes orales directos podría reducir el riesgo de ataque cerebrovascular a expensas de un incremento en el riesgo de sangrado (por cada 1000 pacientes tratados se prevendrían 10 ACV isquémicos y se producirían 17 sangrados mayores). Por tanto, su utilización en este escenario sería condicional al riesgo de sangrado, la valoración de beneficio y preferencias del paciente, así como los resultados de nuevos estudios.
*Actividad eléctrica auricular rápida que excede el límite de detección programado por dispositivos implantados y requiere inspección visual para confirmar fibrilación auricular y excluir otras arritmias o errores del dispositivo.
Certeza en la evidencia: muy baja por heterogeneidad clínica y metodológica, evidencia indirecta e imprecisión.
Otros mensajes clave:
- La incidencia de ataque cerebrovascular (ACV)/embolismo sistémico en pacientes con fibrilación auricular subclínica (FAS) o episodios auriculares de alta frecuencia (EAAF) fue de 1-1.2%/paciente-año, considerablemente más baja que en aquellos con FA clínica (3.7%/paciente-año).
- En la población usuaria de dispositivos es común la indicación de ASA. En los estudios evaluados ésta se utilizó como comparador o se permitió su uso por indicación clínica. Como resultado, 3/4 partes de los participantes del grupo control recibieron ASA. En FA esta terapia no reduce el riesgo de ACV e incrementa el riesgo de sangrado.
Es importante saber lo que no se conoce:
- Hubo información insuficiente para evaluar la gravedad de los ACV y los eventos de sangrado mayor.
- No se conoce si la anticoagulación oral en pacientes FAS/EAAF modifica los desenlaces de muerte cardiovascular o por todas las causas.
- Se desconoce el efecto de la anticoagulación oral en pacientes no portadores de marcapasos, CDI o cardioresincronizadores, incluidos aquellos que usan dispositivos no implantables de tamizaje de FA.
Antecedentes
La fibrilación auricular (FA), arritmia reconocida por su asociación con cardioembolismo sistémico (1), falla cardíaca (2), muerte por todas las causas (3) y deterioro cognitivo (4), tiene una prevalencia cercana al 2-4% en la población general (5). En Colombia, la tasa de prevalencia estandarizada para la edad varía entre 600-699/100.000 personas (6).
Las guías de práctica clínica (GPC) sobre esta arritmia basan sus recomendaciones en esta condición cuando hay manifestaciones clínicas (7-9), indicando la anticoagulación oral para prevenir eventos cardioembólicos. Sin embargo, con el aumento en la disponibilidad y uso de dispositivos de monitorización cardíaca, tanto implantables como de uso cotidiano (V.g. relojes inteligentes), ha aumentado hasta en 28.1% la detección de episodios cortos y asintomáticos de FA, conocidos como FA subclínica (FAS) o episodios auriculares de alta frecuencia (EAAF) (10).
En quienes se detecta FAS/EAAF el riesgo de ACV isquémico supera al de la población general (2.49, IC95% 1.28-4.85) (13), aunque es menor que el de pacientes con FA clínica documentada por ECG de superficie (1.69%/personas-año versus 3.7%/personas-año) (14,15). La evidencia sobre la anticoagulación oral en FAS/EAAF es escasa y en su mayoría de carácter observacional (10-12). Además, los pacientes con dispositivos implantados suelen ser de edad avanzada, presentan una elevada carga de factores de riesgo de ACV y hemorragia grave, lo que hace más compleja la evaluación de riesgo-beneficio del tratamiento con anticoagulantes orales (10). En este contexto, las guías vigentes emiten recomendaciones condicionales a partir de la puntuación CHA2DS2-VASc y la duración de la arritmia* (9).
Para cerrar la brecha de conocimiento sobre la eficacia y seguridad de la anticoagulación oral en pacientes con FAS/EAAF, se desarrollaron los ensayos clínicos NOAH-AFNET 6 (pacientes con EAAF comparando edoxabán versus placebo o ASA) y ARTESIA (pacientes con FAS comparando apixabán versus ASA) (16, 17). No obstante, sus resultados han sido contradictorios siendo desfavorables en el primero, el cual fue interrumpido prematuramente debido a la observación de un incremento en el riesgo de sangrado mayor (HR 1.31, IC95% 1.02-1.67) y el análisis no programado que mostró un resultado indeterminado de eficacia para ACV isquémico (HR 0.81, IC95% 0.60-1.08) (16).
Ante la publicación de estos estudios y la divergencia de sus resultados, este Recado explora la evidencia sobre los efectos de la anticoagulación oral en los escenarios de FAS o EAAF documentados por dispositivos cardiacos.
*Según el sistema de clasificación de recomendaciones de la Asociación Americana del Corazón (AHA por sus siglas en inglés): recomendación 2aB en pacientes con CHA2DS2-VASc ≥2 y duración ≥24 horas y 2bB con puntuación ≥3 y duración de 5 minutos a 24 horas. No se recomienda (III) si la duración es menor a 5 minutos.
Información en la que se basa este Recado
La búsqueda de literatura exploró las bases de datos MEDLINE, EMBASE y Cochrane library (a 04 de febrero de 2024), con énfasis en revisiones sistemáticas. Se incluyeron los términos “atrial fibrillation”, “subclinical”, “asymptomatic”, “silent”, “atrial high-rate episodes”, “oral anticoagulants”. De los 82 registros recuperados (sin duplicados) se consideraron relevantes los estudios de Projetti et al (10), Vitolo et al (13), Mahajan et al (18), Dondoulakis et al (19), Saglietto et al (20) y McIntyre et al (21). Se reseña este último por ser la única revisión sistemática que combinó resultados de ensayos clínicos en cuanto a anticoagulación oral.
La revisión sistemática (RS) de McIntyre et al. (21) incluyó experimentos que comparaban anticoagulantes orales directos (ACOD) con el tratamiento antiplaquetario o sin tratamiento antitrombótico en pacientes adultos con FAS/EAAF detectada por dispositivos cardiacos. Excluyeron los estudios de pacientes con antecedentes de FA diagnosticada mediante ECG y los estudios realizados exclusivamente en una población con ACV criptogénico o embólico de origen indeterminado.
Como desenlace primario se definió ACV isquémico (incluidos los de etiología no especificada). El resultado secundario fue una combinación de ACV por cualquier causa, embolia sistémica (incluida la embolia arterial periférica la embolia pulmonar y el infarto de miocardio) y muerte cardiovascular.
Otros resultados de eficacia incluyeron cualquier tipo de ACV; un compuesto de ACV isquémico o embolia sistémica; muerte cardiovascular y mortalidad por cualquier causa. El sangrado mayor como desenlace de seguridad estuvo basado en los criterios de la Sociedad Internacional de Trombosis y Hemostasia. Otros desenlaces de seguridad fueron la hemorragia fatal y una combinación de hemorragia fatal y mortalidad por todas las causas.
Para la evaluación crítica de los estudios incluidos, los autores emplearon el instrumento RoB2 de Cochrane.
Resultados
La RS combinó los resultados de los estudios NOAH-AFNET 6 (n=2536) y ARTESIA (n=4012). Los participantes, en su mayoría hombres (63%), de raza blanca (europeos, caucásicos), tuvieron un promedio de edad de 77 años y una mediana de puntuación CHA2DS2-VASc de 4. Las comorbilidades más frecuentes fueron hipertensión arterial (84.2%), diabetes (28%) y falla cardiaca (27.8%).
Cerca del 10% de los participantes tenían antecedentes de ACV, embolia sistémica o Ataque Isquémico Transitorio (AIT) previos. Adicionalmente, el 75% era portador de CDI y la mediana de duración de la FA detectada por dispositivo antes de la inclusión en los estudios fue de 2.15 horas. La duración del seguimiento fue de 1.7-5.3 años. La incidencia de ACV/embolismo sistémico asociado a FAS/EAAF en ambos estudios fue de 1-1.2%/paciente-año, más bajo que el riesgo asociado a FA clínica. En la tabla 1 se presentan las características principales de los experimentos incluidos en el metaanálisis.
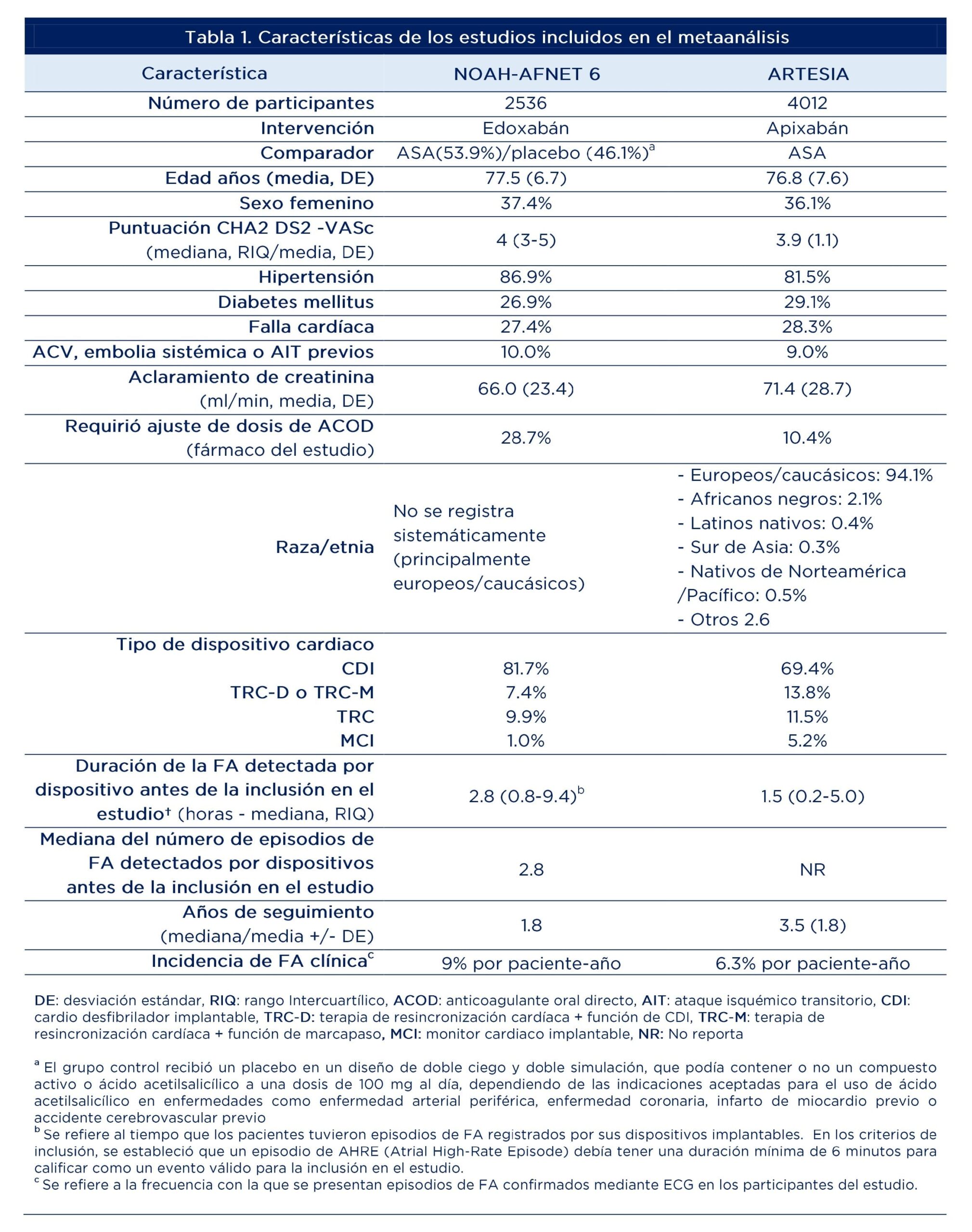
La tabla 2 presenta los resultados primarios y secundarios de eficacia y seguridad. Se identificó una reducción relativa del 32% en el riesgo de ACV isquémico (2.03 versus 3%), al igual que en ACV por cualquier causa (2.34 versus 3.46%) y de 35% para ACV o embolismo sistémico (2.37 versus 3.64%). La reducción fue de 15% para el desenlace combinado de ACV de cualquier causa, embolismo arterial periférico, infarto miocárdico, embolismo pulmonar o muerte cardiovascular. En tanto, no se identificaron diferencias para muerte cardiovascular o por cualquier causa.
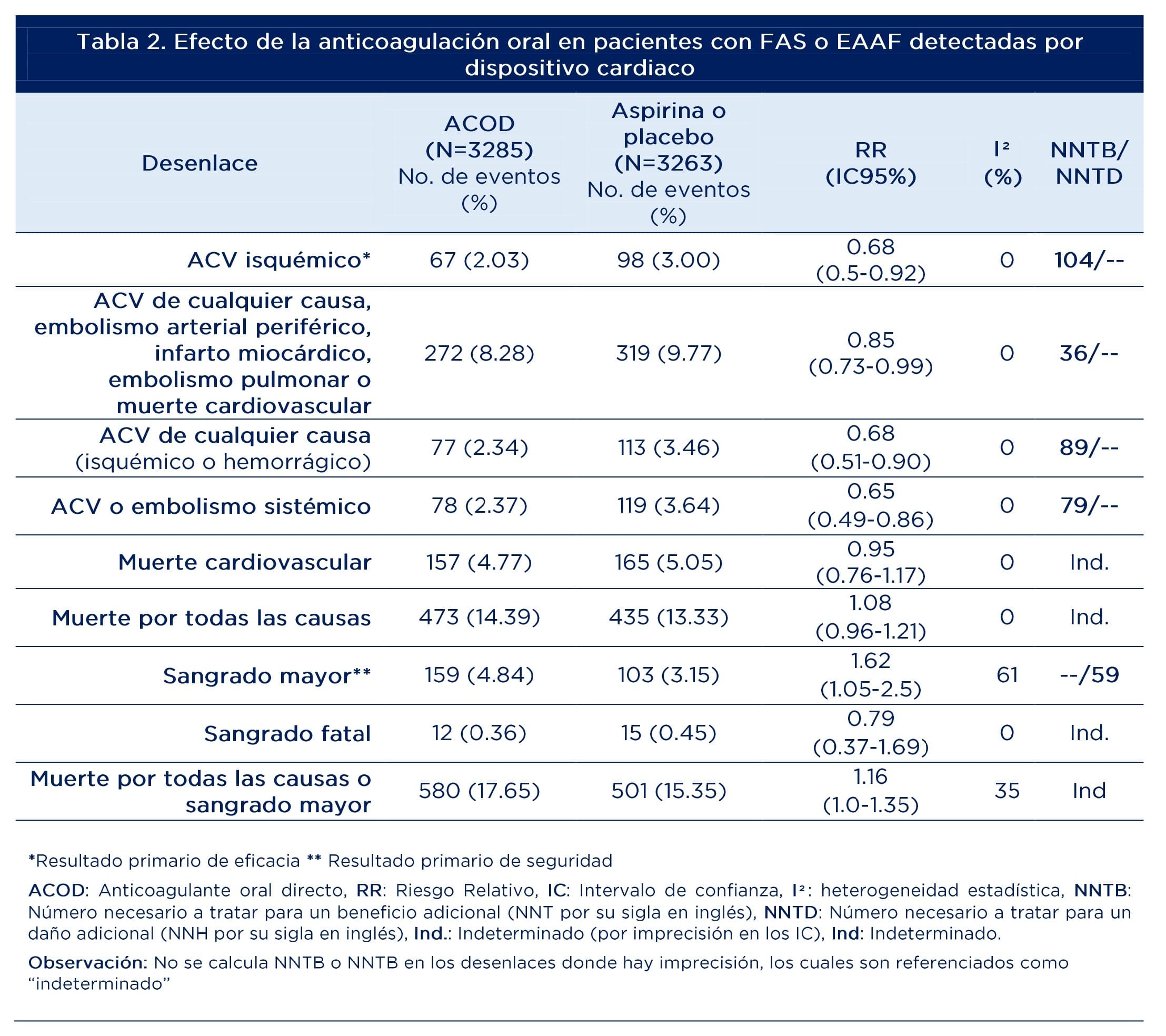
El riesgo de sangrado mayor fue superior en el grupo de ACOD (62% más) comparado con ASA/placebo, siendo incierto en el resultado de sangrado fatal y muerte por todas las causas y sangrado mayor.
Otros aspectos de importancia, que son necesarios al momento de efectuar el balance beneficio/riesgo del uso de ACOD, son:
- La suspensión prematura del estudio NOAH-AFNET 6 (con 184 de los 220 eventos esperados para el desenlace primario) pudo comprometer el poder del estudio para detectar diferencias entre los grupos.
- En el estudio ARTESIA, el riesgo de ACV discapacitante o fatal fue un 49% más bajo con apixabán que con aspirina (HR 0.61, IC95% 0.29-0.88).
- Aunque el riesgo de sangrado mayor fue superior con apixabán (HR 1.8, IC95%, 1.26-2.57), cerca del 90% de los casos fueron manejados con medidas conservadoras (no quirúrgicas).
- No se encontró diferencia respecto de la incidencia de transfusiones entre Apixabán y ASA (26% vs 18%, HR:1.43; IC95% 0.78–2.61)
Los autores señalan como limitaciones del resultado de la RS:
- Las diferencias en las poblaciones, comparadores y desenlaces de los dos estudios (heterogeneidad clínica).
- La falta de datos para el metaanálisis (en el estudio NOAH-AFNET 6) que permitieran evaluar la gravedad de los ACV y los eventos de sangrado mayor.
Si se toman como referencia los desenlaces primarios de eficacia (ACV isquémico) y seguridad (sangrado mayor), el balance beneficio/riesgo (NNTB: 104/NNTD: 59) no favorece el uso de ACOD en pacientes con FAS/EAAF detectada por dispositivos. Sin embargo, deben tenerse en cuenta las limitaciones (bajo poder por suspensión prematura) del estudio NOAH-AFNET 6 con Edoxabán (medicamento no disponible en Colombia) y el manejo no invasivo del sangrado (grupo Apixabán) y la gravedad de los ACV (con Aspirina) en el estudio ARTESIA. La decisión final de usar, por ejemplo, apixabán, estaría condicionada a los perfiles individuales de los pacientes, sus preferencias y la extrapolación empírica de las escalas de embolismo sistémico (CHA2DS2 VASc) y de sangrado (HASBLED/ORBIT) en este grupo específico de pacientes.
Información sobre la evidencia que soporta este Recado
No se encontraron falencias críticas en la evaluación del estudio con la herramienta AMSTAR 2 (22) (anexo 1). Los autores de la RS concluyeron bajo riesgo de sesgos en los estudios primarios a partir del instrumento RoB2 de Cochrane (23).
La certeza global en la evidencia se concluyó baja por cuenta de (anexo 2: Tablas GRADE).
- Evidencia indirecta: la aplicabilidad de la evidencia resumida se compromete al momento de extrapolar el uso de ASA.
- El tratamiento con ASA no forma parte del cuidado estándar actual en FA o EAAF, incluidos los pacientes de bajo riesgo (9).
- En pacientes que toman ASA a quienes se les documenta FA, las GPC recomiendan monoterapia con ACOD en lugar de doble terapia antitrombótica. La principal excepción seria la doble o triple terapia en el contexto de FA más intervención coronaria percutánea por SCA (22).
- El haber utilizado ASA como comparador puede aumentar el riesgo de sangrado en el grupo control, y así reducir las diferencias con el grupo intervenido, subestimando el NNTD.
- Heterogeneidad: Clínica por las diferencias en la población, intervenciones y desenlaces. Adicionalmente, la valoración de la heterogeneidad estadística se ve limitada cuando se agregan menos de 5 estudios en un metaanálisis.
- Imprecisión: bajo número de eventos e inclusión del valor nulo de no efecto en el intervalo de confianza en algunos desenlaces críticos.
Unidad de Síntesis y Transferencia de Conocimiento | Correspondencia: jvillarc@lacardio.org
Rodríguez, J*; Villar J**; Moreno, K**; Cruz, J**; Balcázar M+
(*)Desarrollo, (**)Edición, (+)Diseminación
¿Tienes una pregunta clínica que nuestra Unidad de Síntesis y Transferencia del Conocimiento pueda resolver a través de evidencia científica?
Sí, enviar pregunta
Referencias
Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med. 1994 Jul 11;154(13):1449-57
Prabhu S, Voskoboinik A, Kaye DM, Kistler PM. Atrial Fibrillation and Heart Failure - Cause or Effect? Heart Lung Circ. 2017 Sep;26(9):967-974. doi: 10.1016/j.hlc.2017.05.117
Leong DP, Eikelboom JW, Healey JS, Connolly SJ. Atrial fibrillation is associated with increased mortality: causation or association? Eur Heart J. 2013 Apr;34(14):1027-30. doi: 10.1093/eurheartj/eht044
Diener HC, Hart RG, Koudstaal PJ, Lane DA, Lip GYH. Atrial Fibrillation and Cognitive Function: JACC Review Topic of the Week. J Am Coll Cardiol. 2019 Feb 12;73(5):612-619. doi: 10.1016/j.jacc.2018.10.077.
Benjamin EJ, Muntner P, Alonso A, Bittencourt MS, Callaway CW, Carson AP et al; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation. 2019 Mar 5;139(10):e56-e528. doi: 10.1161/CIR.0000000000000659.
Chugh SS, Havmoeller R, Narayanan K, Singh D, Rienstra M, Benjamin EJ et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014 Feb 25;129(8):837-47. doi: 10.1161/CIRCULATIONAHA.113.005119
Andrade JG, Aguilar M, Atzema C, Bell A, Cairns JA et al; Members of the Secondary Panel. The 2020 Canadian Cardiovascular Society/Canadian Heart Rhythm Society Comprehensive Guidelines for the Management of Atrial Fibrillation. Can J Cardiol. 2020 Dec;36(12):1847-1948. doi: 10.1016/j.cjca.2020.09.001.
Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C et al; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1;42(5):373-498. doi: 10.1093/eurheartj/ehaa612.
Joglar JA, Chung MK, Armbruster AL, Benjamin EJ, Chyou JY, Cronin EM et al. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2024 Jan 2;149(1):e1-e156. doi: 10.1161/CIR.0000000000001193
Proietti M, Romiti GF, Vitolo M, Borgi M, Rocco AD, Farcomeni A et al. Epidemiology of subclinical atrial fibrillation in patients with cardiac implantable electronic devices: A systematic review and meta-regression. Eur J Intern Med. 2022 Sep;103:84-94. doi: 10.1016/j.ejim.2022.06.023.
Healey JS, Connolly SJ, Gold MR, Israel CW, Van Gelder IC, Capucci A, Lau CP, Fain E, Yang S, Bailleul C, Morillo CA, Carlson M, Themeles E, Kaufman ES, Hohnloser SH; ASSERT Investigators. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med. 2012 Jan 12;366(2):120-9. doi: 10.1056/NEJMoa1105575.
Perino AC, Fan J, Askari M, Heidenreich PA, Keung E, Raitt MH, Piccini JP, Ziegler PD, Turakhia MP. Practice Variation in Anticoagulation Prescription and Outcomes After Device-Detected Atrial Fibrillation. Circulation. 2019 May 28;139(22):2502-2512. doi: 10.1161/CIRCULATIONAHA.118.038988
Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R et al; AVERROES Steering Committee and Investigators. Apixabán in patients with atrial fibrillation. N Engl J Med. 2011 Mar 3;364(9):806-17. doi: 10.1056/NEJMoa1007432
Boriani G, Healey JS, Schnabel RB, Lopes RD, Calkins H, Camm JA, Freedman B. Oral anticoagulation for subclinical atrial tachyarrhythmias detected by implantable cardiac devices: an international survey of the AF-SCREEN Group. Int J Cardiol. 2019 Dec 1;296:65-70. doi: 10.1016/j.ijcard.2019.07.039
Vitolo M, Imberti JF, Maisano A, Albini A, Bonini N, Valenti AC, Malavasi VL, Proietti M, Healey JS, Lip GY, Boriani G. Device-detected atrial high rate episodes and the risk of stroke/thrombo-embolism and atrial fibrillation incidence: a systematic review and meta-analysis. Eur J Intern Med. 2021 Oct;92:100-106. doi: 10.1016/j.ejim.2021.05.038
Adabag S, Chen J, Karim R. Anticoagulation with Edoxaban in Patients with Atrial High-Rate Episodes. N Engl J Med. 2023 Dec 14;389(24):2302-2303. doi: 10.1056/NEJMc2312837
Healey JS, Lopes RD, Granger CB, Alings M, Rivard L et McIntyre WF; ARTESIA Investigators. Apixabán for Stroke Prevention in Subclinical Atrial Fibrillation. N Engl J Med. 2024 Jan 11;390(2):107-117. doi: 10.1056/NEJMoa2310234
Mahajan R, Perera T, Elliott AD, Twomey DJ, Kumar S, Munwar DA et al. Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J. 2018 Apr 21;39(16):1407-1415. doi: 10.1093/eurheartj/ehx731
Doundoulakis I, Gavriilaki M, Tsiachris D, Arsenos P, Antoniou CK, Dimou S et al.Atrial High-Rate Episodes in Patients with Devices Without a History of Atrial Fibrillation: a Systematic Review and Meta-analysis. Cardiovasc Drugs Ther. 2022 Oct;36(5):951-958. doi: 10.1007/s10557-021-07209-8
Saglietto A, Ballatore A, Griffith Brookles C, Xhakupi H, De Ferrari GM, Anselmino M. Role of atrial high-rate episodes in stratifying thromboembolic risk: a multiple cut-off diagnostic meta-analysis. Front Cardiovasc Med. 2023 Nov 7;10:1289372. doi: 10.3389/fcvm.2023.1289372
McIntyre WF, Benz AP, Becher N, Healey JS, Granger CB et al. Direct Oral Anticoagulants for Stroke Prevention in Patients with Device-Detected Atrial Fibrillation: A Study-Level Meta-Analysis of the NOAH-AFNET 6 and ARTESiA Trials. Circulation. 2023 Nov 12. doi: 10.1161/CIRCULATIONAHA.123.067512
Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017 Sep 21;358:j4008. doi: 10.1136/bmj.j4008.
Sterne JAC, Savović J, Page MJ, Elbers RG, Blencowe NS, Boutron I, Cates CJ, Cheng HY, Corbett MS, Eldridge SM, Emberson JR, Hernán MA, Hopewell S, Hróbjartsson A, Junqueira DR, Jüni P, Kirkham JJ, Lasserson T, Li T, McAleenan A, Reeves BC, Shepperd S, Shrier I, Stewart LA, Tilling K, White IR, Whiting PF, Higgins JPT. RoB 2: a revised tool for assessing risk of bias in randomised trials. BMJ. 2019 Aug 28;366:l4898. doi: 10.1136/bmj.l4898.
Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A et al; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023 Oct 12;44(38):3720-3826. doi: 10.1093/eurheartj/ehad191
