Versión 1 - 14/02/2024
Evidencia experimental muestra que en mujeres* con riesgo promedio, el tamizaje bianual para cáncer de mama desde los 40 años, comparado con iniciarlo a los 50 años, favorece la detección temprana y reduce el riesgo de muerte por esta causa. Por tanto, se recomienda iniciar la invitación al tamizaje en edades más tempranas, asumiendo que los costos y potenciales efectos negativos del tamizaje son similares a los de una iniciación más tardía.
Certeza en la evidencia:
- Moderada para mortalidad por cáncer de mama en mujeres desde 40 años, por riesgo serio de sesgos
- Baja para mortalidad por cáncer de mama en mujeres mayores de 70 años, por riesgo muy serio de sesgos
*Personas de sexo femenino, independiente del género con el que se identifiquen.
Otros mensajes clave:
- La recomendación no aplica para mujeres con mutaciones genéticas (BRCA1/2), antecedentes de radioterapia a altas dosis en región torácica, cáncer de mama o historia de lesión mamaria de alto riesgo en biopsias.
Buena práctica clínica:
- En mujeres con antecedente personal o familiar de cáncer de mama, tubo-ovárico, peritoneal o mutación en los genes BRCA1/2, se debe evaluar el riesgo y remitir para consejería genética.
- Para lograr el beneficio del tamizaje, es importante que todas las pacientes con resultado anormal en su mamografía, continúen la ruta de atención para caracterizar los hallazgos y recibir un tratamiento oportuno y eficaz.
Es importante saber lo que no se conoce:
- Se desconoce el beneficio del tamizaje con mamografía en pacientes mayores de 70 años.
Antecedentes
El cáncer de mama es el tumor maligno más frecuentemente diagnosticado a nivel mundial, con una incidencia de 2.260.419 casos en el año 2020, superando al cáncer de pulmón (1, 2). Se estima que para el año 2050 los casos incidentes superen los 4.781.849 (3). En mujeres es la primera causa de mortalidad con un estimado de 685,000 muertes a nivel global, lo que representa el 15,5% de todas las muertes por cáncer (4). En Colombia, de los 60,355 casos de cáncer diagnosticados en mujeres en el 2020, 26% fueron cáncer de mama, siendo también la primera causa de mortalidad por cáncer en esta población (5).
A nivel global la sobrevida ha mejorado debido, entre otros factores, al aumento en la detección a través de programas de tamizaje (6). Estos programas tienen como objetivo reducir la mortalidad a través de la detección temprana y el tratamiento eficaz (4,7). El método de tamizaje recomendado es la mamografía digital, cuya sensibilidad fluctúa entre 75-95% y su especificidad entre 80-95% (8). Una revisión sistemática (RS) del U.S. Preventive Service Task Force (USPSTF) de 2016 sobre el impacto clínico del tamizaje para cáncer de mama, mostró que realizar mamografía en mujeres entre 50 y 69 años reduce (19% – 31%) la mortalidad por esta causa (9). Sin embargo, en los países en vía de desarrollo las barreras en el acceso para la prevención y detección temprana limitan estos beneficios (5,6).
Además de optimizar su implementación, las ventajas del tamizaje podrían extenderse mejorando los equipos utilizados o ampliando los grupos de edad de la población susceptible. La mamografía digital y la tomosíntesis (DBT, por sus siglas en inglés) son dos técnicas emergentes para el tamizaje de cáncer de mama (10). A pesar de un posible mayor rendimiento diagnóstico aplicable a mujeres de menor edad (11), estas técnicas no se han comparado directamente en términos de mortalidad, morbilidad o calidad de vida (12,13). Respecto a la edad, se ha reportado que en mujeres menores de 50 años se presentan más frecuentemente los subtipos más agresivos de cáncer de mama (14). También, después de los 70 años hay un exceso de incidencia del 4%, sumado a las otras comorbilidades (15).
Al considerar estas variables, las sociedades científicas han emitido recomendaciones heterogéneas sobre edad de inicio, intervalos de evaluación, edad de finalización y los métodos de tamizaje. Este Recado aborda la evidencia reciente sobre el efecto del tamizaje de cáncer de mama y mortalidad por todas las causas en mujeres en diferentes grupos de edad.
Información en la que se basa este Recado
Se presenta una evaluación crítica de la RS No. 123 realizada por USPSTF (11) identificado por monitoreo periódico de repositorios de información. Esta RS fue seleccionada por su vigencia y rigor metodológico.
Este estudio examina la efectividad de diferentes estrategias de tamizaje para cáncer de mama y su impacto en mortalidad, morbilidad, detección de cáncer invasivo y daños por sobrediagnóstico o sobretratamiento, actualizando recomendaciones previas de 2016 (16).
Resultados
Los autores de esta revisión tomaron como referencia la combinación de los resultados de 4 experimentos aleatorizados que incluyeron 170.393 participantes (mujeres 40-65 años sin antecedente de cáncer de mama), con seguimientos de 22 a 30 años. Los pacientes asignados a los grupos de intervención recibieron una invitación a tamizaje con intervalos de 18-28 meses (RIQ: 10 meses) y una mediana de 4.5 rondas de tamizaje. Aquellos asignados al grupo control recibieron sólo una ronda de tamizaje al final del estudio, simultánea con la ronda final del grupo de intervención.
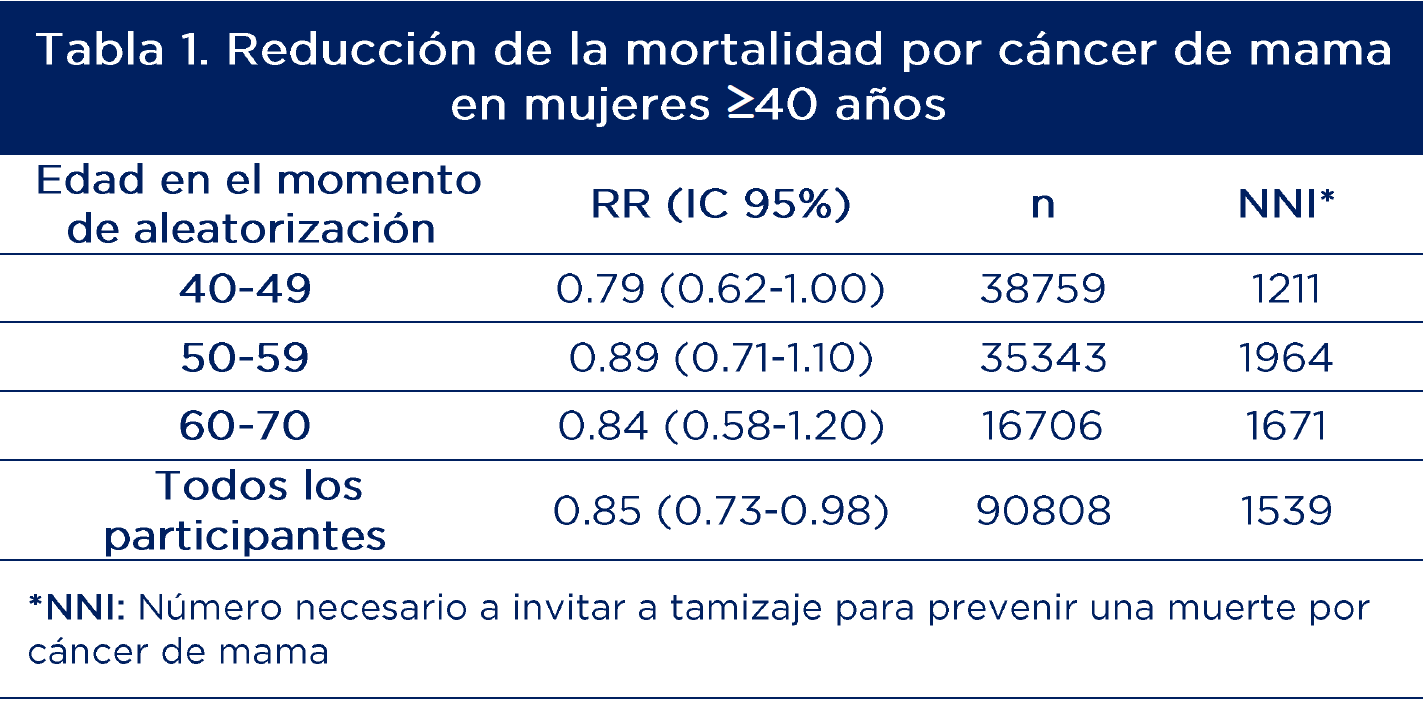
Se encontró una reducción del riesgo de mortalidad por cáncer de mama del 21% para las participantes de 40-49 años al ingreso y 11% para las de 50-59 años. Los resultados agrupados mostraron una reducción en el riesgo de mortalidad por cáncer de mama del 15% (RR 0.85, IC95% 0.73-0.98) (tabla 1).
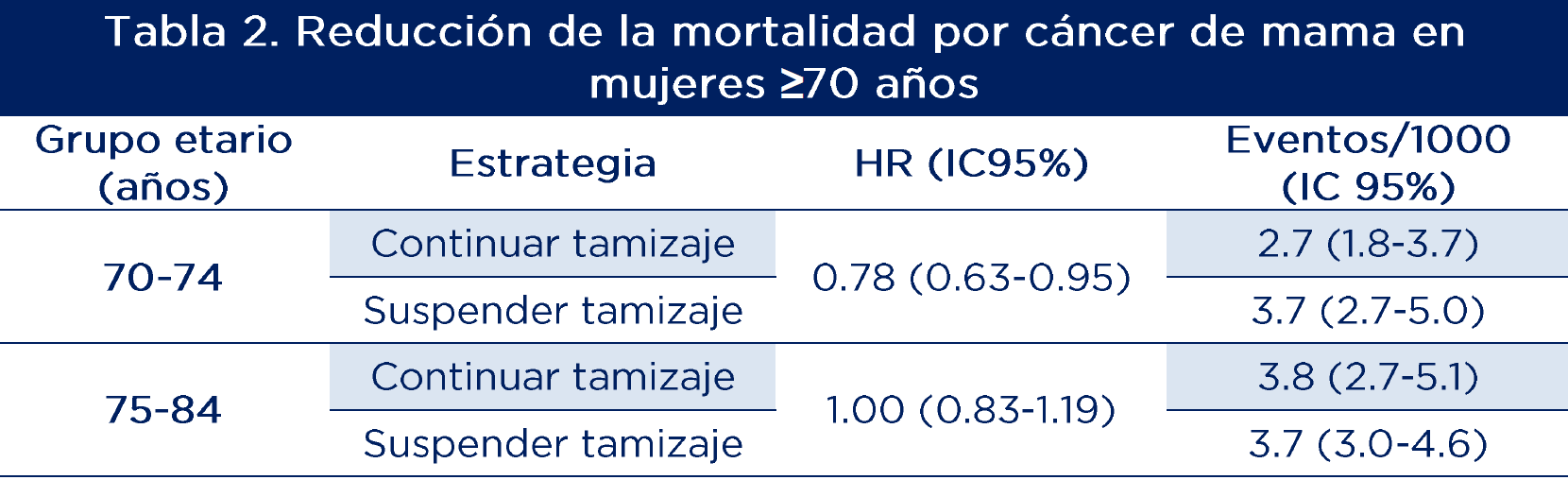
Para evaluar la efectividad de continuar el tamizaje con mamografía vs. suspenderlo en mujeres mayores de 70 años, los autores efectuaron la simulación de un ensayo clínico con datos observacionales (15).
A partir de una muestra de 264.274 individuos seguidos en promedio por 8 años, se registraron 294 pacientes con cáncer de mama. En mujeres entre 70-74 años la tasa de eventos fue 2.7/1000 (IC 95% 1.8-3.7) en el grupo invitado a tamizaje, comparado con 3.7/1000 (IC 95% 2.7-5.0) en el grupo control (diferencia absoluta de riesgo -1.0, IC95% -2.3 a 0.1; HR 0.78, IC95% 0.63-0.95). El resultado no se modificó al ajustar el análisis por variables tiempo dependiente. Por otro lado, en mujeres de 75-84 años la diferencia del riesgo fue de 0.07 (IC 95% -0.93 a 1.30) con un HR 1.0 (IC 95% 0.83-1.19) (tabla 2).
Por otra parte, se incluyó un experimento no aleatorizado que analizó 14.765 mujeres ≥40 años, distribuidas en intervalos de tamizaje anual y trienal, con un seguimiento de 10 años (17). Para el tamizaje anual, se encontró un aumento estimado del 20% en el riesgo de mortalidad por todas las causas (RR 1.20 IC 95% 0.99-1.46). En el análisis de intención a tratar (mortalidad por casos prevalentes e incidencia de cáncer de mama) fue mayor en el tamizaje anual (230.9 por 100.000 personas-años) comparado con tamizaje trienal (192.6 por 100.000 personas-años).
Finalmente, se encontró que el tamizaje anual de cáncer de mama presenta mayores tasas de falsos positivos comparado con el bianual (OR 2.2 IC95% 1.7-2.8). Entre el 50-56% de mujeres que reciben tamizaje anual en un período de 10 años presentaron al menos un resultado falso positivo y 12% biopsias con resultado falso positivo (18).
Información sobre la evidencia que soporta este Recado
La calificación de la calidad de los estudios individuales, basada en la herramienta del USPSTF que califica la validez interna en tres niveles (buena, aceptable o pobre) (11), fue considerada por los autores de la RS entre aceptable y buena. Luego de aplicar la herramienta AMSTAR 2 se concluye confianza alta en los resultados de la RS. Aplicando la herramienta GRADE se concluye certeza moderada para tamizaje a partir de los 40 años por riesgo serio de sesgo y certeza baja para tamizaje en >70 años por riesgo muy serio de sesgo (Anexo. Tabla GRADE).
Unidad de Síntesis y Transferencia de Conocimiento | Correspondencia: jvillarc@lacardio.org
Angel, F*; Rodríguez, J*; Villar J**; Moreno, K**; Cruz, J**; Balcázar M**+
(*)Desarrollo, (**)Edición, (+)Diseminación
¿Tienes una pregunta clínica que nuestra Unidad de Síntesis y Transferencia del Conocimiento pueda resolver a través de evidencia científica?
Sí, enviar pregunta
Referencias
Arnold M, Morgan E, Rumgay H, Mafra A, Singh D, Laversanne M, et al. Current and future burden of breast cancer: Global Statistics for 2020 and 2040. The Breast. 2022 Dec;66:15–23. doi:10.1016/j.breast.2022.08.010
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. cáncer: A Cancer Journal for Clinicians. 2021 Feb 4;71(3):209–49. doi:10.3322/caac.21660
Xu Y, Gong M, Wang Y, Yang Y, Liu S, Zeng Q. Global trends and forecasts of breast cancer incidence and deaths. Scientific Data. 2023 May 27;10(1). doi:10.1038/s41597-023-02253-5
Lei S, Zheng R, Zhang S, Wang S, Chen R, Sun K, et al. Global patterns of breast cancer incidence and mortality: A population‐based cancer registry data analysis from 2000 to 2020. Cancer Communications. 2021 Nov 16;41(11):1183–94. doi:10.1002/cac2.12207
Duarte C, Salazar A, Strasser-Weippl K, de Vries E, Wiesner C, Arango-Gutiérrez A, et al. Breast cancer in Colombia: A growing challenge for the healthcare system. Breast Cancer Research and Treatment. 2021 Feb 21;186(1):15–24. doi:10.1007/s10549-020-06091-6
Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. cáncer: A Cancer Journal for Clinicians. 2021 Feb 4;71(3):209–49. doi:10.3322/caac.21660
Tabár L, Dean PB, Chen TH, Yen AM, Chen SL, Fann JC, et al. The incidence of fatal breast cancer measures the increased effectiveness of therapy in women participating in Mammography Screening. Cancer. 2018 Feb 8;125(4):515–23. doi:10.1002/cncr.31840
Smolarz B, Nowak AZ, Romanowicz H. Breast cancer—epidemiology, classification, pathogenesis and treatment (review of literature). Cancers. 2022 May 23;14(10):1–27. doi:10.3390/cancers14102569
Siu AL. Screening for breast cancer: U.S. Preventive Services Task Force Recommendation Statement. Annals of Internal Medicine. 2016 Feb 12;164(4):279. doi:10.7326/m15-2886
Pattacini P, Nitrosi A, Giorgi Rossi P, Duffy SW, Iotti V, Ginocchi V, et al. A randomized trial comparing breast cancer incidence and interval cancers after tomosynthesis plus mammography versus mammography alone. Radiology. 2022 Feb 1;303(2):256–66. doi:10.1148/radiol.211132
Henderson JT, Webber EM, Weyrich M, Miller M, Melnikow J. Breast cancer: Screening [Internet]. US Preventive Services Taskforce; 2023 [cited 2023 Oct 12]. Available from: https://www.uspreventiveservicestaskforce.org/uspstf/draft-recommendation/breast-cancer-screening-adults#bcei-recommendation-title-area
Østerås BH, Martinsen AC, Gullien R, Skaane P. Digital Mammography Versus Breast Tomosynthesis: Impact of breast density on diagnostic performance in population-based screening. Radiology. 2019 Oct;293(1):60–8. doi:10.1148/radiol.2019190425
Ko MJ, Park DA, Kim SH, Ko ES, Shin KH, Lim W, et al. Accuracy of digital breast tomosynthesis for detecting breast cancer in the diagnostic setting: A systematic review and meta-analysis. Korean Journal of Radiology. 2021 Jan;22(8):1240–52. doi:10.3348/kjr.2020.1227
Duffy SW, Vulkan D, Cuckle H, Parmar D, Sheikh S, Smith RA, et al. Effect of mammographic screening from age 40 years on breast cancer mortality (UK age trial): Final results of a randomised, controlled trial. The Lancet Oncology. 2020 Sept;21(9):1165–72. doi:10.1016/s1470-2045(20)30398-3
García-Albéniz X, Hernán MA, Logan RW, Price M, Armstrong K, Hsu J. Continuation of annual screening mammography and breast cancer mortality in women older than 70 years. Annals of Internal Medicine. 2020;172(6):381. doi:10.7326/m18-1199
Nyström L, Bjurstam N, Jonsson H, Zackrisson S, Frisell J. Reduced breast cancer mortality after 20+ years of follow-up in the Swedish randomized controlled mammography trials in Malmö, Stockholm, and Göteborg. Journal of Medical Screening. 2016;24(1):34–42. doi:10.1177/0969141316648987
Parvinen I, Chiu S, Pylkkänen L, et al. Effects of annual vs triennial mammography interval on breast cancer incidence and mortality in ages 40-49 in Finland. Br J Cancer. 2011;105(9):1388-1391. doi:10.1038/bjc.2011.372
McGuinness JE, Ueng W, Trivedi MS, et al. Factors Associated with False Positive Results on Screening Mammography in a Population of Predominantly Hispanic Women. Cancer Epidemiol Biomarkers Prev. 2018;27(4):446-453. doi:10.1158/1055-9965.EPI-17-0009