Versión 1 - 03/03/21
Un estudio no replicado de moderada calidad en trabajadores de la salud seropositivos* sugiere un riesgo sustancialmente menor de reinfección por SARS-CoV-2 en el mediano plazo (seis meses) comparado con la incidencia de infección en aquellos inicialmente seronegativos. Estos hallazgos podrían informar la priorización de grupos de vacunación, considerando la disponibilidad de vacunas y la capacidad de aplicación, hasta que evidencia de mayor calidad indique lo contrario.
Calidad de la evidencia: moderada (se basa en un estudio de cohorte de buena calidad metodológica con bajo número de casos incidentes).
*Con anticuerpos detectables IgG anti -spike y anti-nucleocápside
Buena práctica para pacientes
Aunque ya haya sido diagnosticado con COVID-19 debe mantener las medidas de protección personal (distanciamiento físico, ambientes ventilados, uso de tapabocas cubriendo nariz y boca y lavado de manos) mientras accede a la vacunación de acuerdo con su grupo de priorización.
Otros mensajes clave:
- Después de la generación de anticuerpos (AC) inducidos por una infección por SARS-CoV-2, se observa un riesgo bajo de reinfección en la mayoría de los individuos hasta por 6 meses.
- La presencia y niveles de títulos de AC anti-spike y anti-nucleocápside (incluso cuando están por debajo del umbral positivo) se asocia con una menor incidencia de infección por SARS-CoV-2.
- Un mayor conteo de títulos de AC anti-spike se asocia con una menor probabilidad de PCR positiva durante las 31 semanas de seguimiento.
Es importante saber lo que no se conoce
No se conoce si la protección contra la reinfección se debe a los AC o a la inmunidad celular.
Es incierto si el riesgo de reinfección continúa siendo bajo luego de seis meses.
Se desconoce si la baja tasa de reinfección observada puede extrapolarse a otras poblaciones (niños, adultos mayores, pacientes con condiciones preexistentes o inmunosuprimidos).
No se conocen los factores del huésped (niveles o tipos de respuesta inmune, comorbilidades, etc.) que se asocian al riesgo de reinfección.
Antecedentes
La infección por SARS-CoV-2 produce una respuesta inmune en la mayoría de los individuos. Sin embargo, existe incertidumbre respecto a la duración de la protección contra una eventual reinfección (1). La respuesta y memoria inmunológica ante el SARS-CoV-2 está mediada por la respuesta celular y humoral con la producción de células TCD4+ y células TCD8+ y AC específicos (2). En algunos estudios se ha observado que la respuesta de las células T se asocia con una reducción de la enfermedad. De la misma manera, la falta de una respuesta innata efectiva se ha asociado con una falla en el control de la infección primaria y alto riesgo de presentar COVID-19 fatal (2,3).
En cuanto a la respuesta humoral, se ha observado que la seroconversión de la mayoría de los individuos con COVID-19 ocurre entre 7 a 14 días después del diagnóstico (4). Se ha postulado que existe una relación entre la gravedad de COVID-19 y los títulos de AC a partir de la segunda semana del inicio de síntomas (5). También, la producción de AC neutralizantes se ha asociado con una inmunidad protectora contra la reinfección por SARS-CoV-2 en modelos animales (2). En humanos se postula que en especial los AC IgG contra el dominio de unión al receptor de la proteína spike (o espiga) del SARS-COV-2 y anti-nucleocápside pueden proporcionar alguna inmunidad posinfección, con títulos de AC observados hasta los 6 – 8 meses (2,6).
Un reporte reciente acerca del aumento de casos de COVID-19 en Manaos, Brasil, postula como uno de los posibles factores asociados el descenso en la inmunidad contra SARS-COV-2 después de la primera exposición (7). Esta observación está en línea con la disminución de títulos de AC IgG anti-nucleocápside reportada en donantes de sangre de esta región (8).
La relación entre la presencia de anticuerpos para SARS-COV-2 y el riesgo de reinfección no se conoce con certeza No obstante, en atención a la magnitud de la pandemia, es mínimo el reporte de casos de COVID-19 severo en pacientes previamente infectados (9).
Este Recado reseña un estudio de cohorte (10) que evaluó la asociación entre la presencia de anticuerpos contra SARS-CoV-2 y el riesgo de reinfección.
Información en la que se basa este Recado
Este Recado presenta una evaluación crítica del estudio realizado por Lumley et al. identificado por monitoreo periódico de repositorios de información de fuentes seleccionadas.
Resultados
Lumley et al. (10) reportan un experimento natural en 4 hospitales universitarios de Oxfordshire, Reino Unido, para evaluar la asociación entre la presencia de AC contra SARS-CoV-2 y el riesgo de reinfección. Durante un semestre, estos hospitales ofrecieron a los profesionales de la salud pruebas de PCR para SARS-CoV-2 de muestras de hisopado nasal y orofaríngeo independiente de la presencia de síntomas relacionados (tos nueva persistente, temperatura ≥37.8°, anosmia o ageusia). Los participantes eran libres de asistir a la realización de la prueba sin tiempos estipulados.
Las investigaciones serológicas se realizaron con un ensayo inmunoabsorbente ligado a la enzima (ELISA) para IgG anti-spike trimérico* (desarrollado por la Universidad de Oxford) y un ensayo IgG anti-nucleocápside (de Abbott).
Se incluyeron 12 715 profesionales de la salud con resultados disponibles de IgG que conformaban tres grupos: uno con al menos un resultado positivo para la prueba ELISA IgG anti-spike trimérico, otro con por lo menos un resultado positivo para la prueba IgG anti-nucleocápside y un tercero con resultados de ambas pruebas. Los primeros dos grupos constituyeron el análisis primario y el último (que involucra ambas pruebas) el análisis secundario (figura 1):
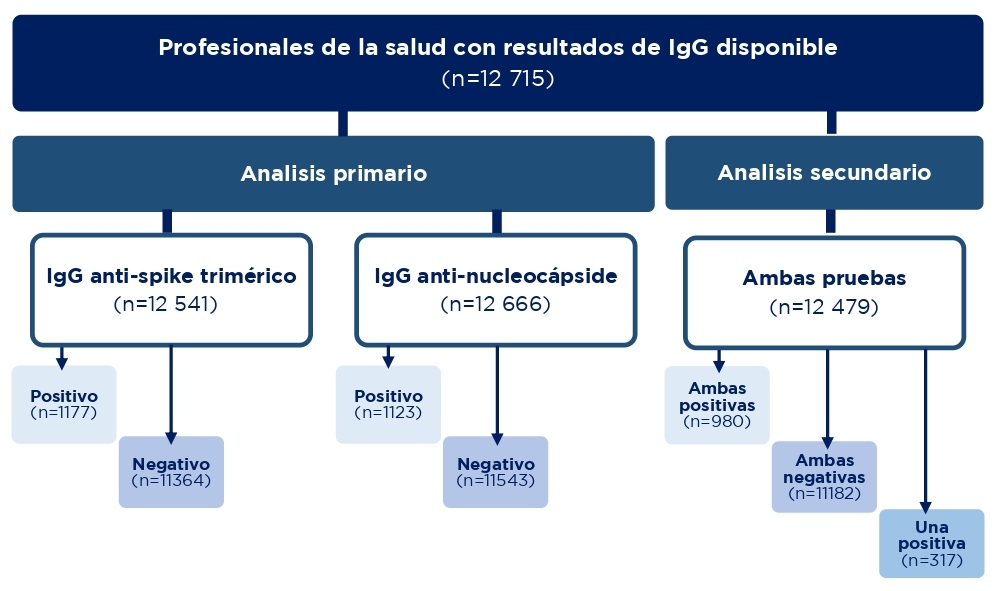
Los profesionales de la salud se clasificaron en dos subgrupos de acuerdo con los resultados de cada prueba: aquellos con solo pruebas de AC negativas (seronegativos) y aquellos con alguna prueba de AC positiva (seropositivos). Los seronegativos se consideraron a riesgo de infección hasta el final del estudio o su primera prueba PCR positiva, lo que ocurriera primero. Los seropositivos (después de 60 días** de su diagnóstico inicial por PCR) se consideraban a riesgo de reinfección hasta el final del seguimiento o la aparición de una prueba positiva, lo que ocurriera primero.
El seguimiento inició entre marzo y abril y finalizó el 30 de noviembre de 2020, con una mediana de seguimiento de 200 días (RIQ: 180 a 207) en los seronegativos y 139 días (RIQ: 117 a 147) en los seropositivos.
Para el análisis primario se usaron los resultados de 12 541 profesionales de la salud con prueba ELISA IgG anti-spike trimérico; 90.6% (n=11 364) seronegativos y 9.4% (n=1 177) seropositivos, con una mediana de edad de 38 años (RIQ: 29-49 años). Se usaron los resultados de 12 666 profesionales de la salud con prueba IgG anti-nucleocápside; 91.1% (n=11 543) seronegativos y 8.9% (n=1 123) seropositivos.
Para el análisis secundario se usaron los resultados de 12 479 profesionales de la salud, 89.6% (n=11 182) con ambas pruebas negativas, 7.9% (n=980) con ambas positivas o 2.5% (n=317) con solo una positiva. El análisis se ajustó para incidencia de la infección a lo largo del tiempo, la edad de los profesionales y el sexo reportado. Finalmente, se realizó un análisis de sensibilidad para determinar el impacto de las diferentes tasas de pruebas en profesionales asintomáticos de acuerdo con el estado basal de los AC y las diferentes ventanas de seguimiento.
*Es una glicoproteina que se expresa en la superficie del virus SARS-CoV-2 conformada por tres péptidos, cada uno con subunidades S1 y S2 involucradas en el proceso de unión y fusión entre el virus y el huésped.
**Esta ventana de tiempo se definió sobre la base de informes anteriores de la persistencia del ARN del virus durante 6 semanas o más.
Los hallazgos principales sobre pruebas de AC fueron:
Para el análisis primario AC anti-spike:
- La incidencia de COVID-19 fue mayor en el grupo seronegativos y varió según el tiempo calendario, reflejando la primera y segunda olas de la pandemia en el Reino Unido.
- Entre los seronegativos, el 25% (n=2860) recordaron haber tenido síntomas consistentes con los de COVID-19 y solo tuvieron una PCR positiva previa el 0.2% (n=24, todos sintomáticos).
- Entre los seropositivos, el 68% (n=864) recordaron haber tenido síntomas consistentes con los de COVID-19 y se encontró una infección previa confirmada por PCR en el 37% (n=466, 262 sintomáticos).
- En los profesionales que reportaron síntomas, las tasas de pruebas de PCR positivas fueron similares (independientemente del resultado serológico): 8.7 y 8.0 por cada 10 000 días en riesgo, para seropositivos y seronegativos respectivamente.
- Un total de 8 850 profesionales de salud asistió para la realización de al menos una prueba de PCR mientras fueron asintomáticos después de la línea base; el grupo seronegativo asistió a la detección asintomática con más frecuencia que el seropositivo (141 versus 108 por cada 10 000 días en riesgo, respectivamente; RR 0.76, IC95% 0.73-0.80)
- El 0.77% (n=88) de los profesionales presentó seroconversión durante las 31 semanas de seguimiento del estudio.
- Durante el seguimiento, el grupo seropositivo se asoció con tasas más bajas de pruebas de PCR positivas (sugiriendo reinfección) que el grupo seronegativo (sugiriendo primera infección): 0.13 vs 1.09 por cada 10 000 días en riesgo, respectivamente (RR 0.12; IC95% 0.03-0.47).
- Después de ajustar por edad, sexo, mes de prueba o tiempo de calendario como variable continua, la tasa de incidencia de COVID-19 del grupo inicialmente seropositivo fue de 0.11 (IC95%, 0.03-0.44).
Para el análisis primario AC anti-nucleocápside los resultados fueron muy similares:
- Durante el seguimiento, el grupo seropositivo se asoció con tasas más bajas de pruebas de PCR positivas (sugiriendo reinfección) versus e el grupo seronegativo (sugiriendo primera infección): 0.13 vs 1.10 por cada 10 000 días en riesgo, respectivamente.
- Después de ajustar por edad, sexo y tiempo de calendario como variable continua la tasa de incidencia del grupo inicialmente seropositivo fue de 0.11 (IC95% 0.03-0.45).
Los hallazgos principales del análisis secundario fueron:
- Un total de 12 479 trabajadores de la salud contaron con resultados para ambas pruebas serológicas en la línea de base.
- La tasa de pruebas de PCR positivas durante el seguimiento fue:
- Con ambas pruebas serológicas negativas: 1.08 por cada 10 000 días en riesgo.
- Con ambas pruebas positivas: 0.07 por cada 10 000 días en riesgo (IRR 0.06; IC95% 0.01-0.46).
- Con resultados de AC mixtos: 0.49 por cada 10 000 días en riesgo (IRR 0.42; IC95% 0.10-1.69).
- Tres profesionales de la salud seropositivos (uno con ambas pruebas positivas) tuvieron una prueba de PCR positiva (el curso clínico y serológico puede consultarse en (10)).
- El tiempo entre los síntomas iniciales o seropositividad y pruebas de PCR positiva posterior fue entre 160 y 199 días, sugiriendo que se trata de un nuevo evento.
Información sobre la evidencia que soporta este Recado:
El estudio de Lumley se califica como bajo riesgo de sesgo de acuerdo con el herramienta para usuarios de la literatura médica de JAMA para evaluar estudios sobre pronóstico (11), pese a un relativamente corto periodo de seguimiento. De acuerdo con la aproximación GRADE, la calidad de la evidencia se consideró como moderada por ser un estudio de buena calidad metodológica aunque con bajo número de casos de seroconversión.
Referencias
Piri SM, Edalatfar M, Shool S, Jalalian MN, Tavakolpour S. A systematic review on the recurrence of SARS-CoV-2 virus: frequency, risk factors, and possible explanations. Infect Dis (London, England). 2021 Jan;1–10.
Dan JM, Mateus J, Kato Y, Hastie KM, Yu ED, Faliti CE, et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science (80- ). 2021;4063:eabf4063.
Arunachalam PS, Wimmers F, Mok CKP, Perera RAPM, Scott M, Hagan T, et al. Systems biological assessment of immunity to mild versus severe COVID-19 infection in humans. Science (80- ). 2020;369(6508):1210–20.
Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of COVID-19: Current State of the Science. Immunity. 2020;52(6):910–41.
Zhao J, Yuan Q, Wang H et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020;
Muecksch F, Wise H, Batchelor B, Squires M, Semple E, Richardson C, et al. Longitudinal Serological Analysis and Neutralizing Antibody Levels in Coronavirus Disease 2019 Convalescent Patients. J Infect Dis. 2020;(Xx Xxxx):1–10.
Sabino EC, Buss LF, Carvalho MPS, Prete CA, Crispim MAE, Fraiji NA, et al. Resurgence of COVID-19 in Manaus, Brazil, despite high seroprevalence. Lancet. 2021;397:452–5.
Buss LF, Prete CA, Abrahim CMM, Mendrone A, Salomon T, De Almeida-Neto C, et al. Three-quarters attack rate of SARS-CoV-2 in the Brazilian Amazon during a largely unmitigated epidemic. Science (80- ). 2021;371(6526):288–92.
Selvaraj V, Herman K, Dapaah-Afriyie K. Severe, Symptomatic Reinfection in a Patient with COVID-19. R I Med J (2013). 2020 Nov;103(10):24–6.
Lumley SF, O’Donnell D, Stoesser NE, Matthews PC, Howarth A, Hatch SB, et al. Antibody Status and Incidence of SARS-CoV-2 Infection in Health Care Workers. N Engl J Med. 2020;1–8.
Laupacis A, Wells G, Richardson W. Users’ Guides to the Medical Literature: V. How to Use an Article About Prognosis. JAMA - J Am Med Assoc. 1994;272(3):234–237.